
����Ŀ�������������г���������,��ش���������:
(1)д��������ˮ��Һ�е���ķ���ʽ:_________��
(2)���������������������������е�_____��
(3)���� 10.6 g ��������ʵ���Ϊ__________mol�����˹�������ˮ��� 200 mL ��Һ,�����ʵ��� �ʵ���Ũ��Ϊ_________ mol��L-1��ȡ�� 10 mL ����Һ��ˮϡ���� 100 mL�������ʵ����ʵ���Ũ�� Ϊ___ mol��L-1��ϡ�ͺ���Һ�� Na+�����ʵ���Ϊ________ mol��
(4)��д������ CO2 �� NaOH ��Һ��Ӧ�����ӷ���ʽ: _____________
��д������ CO2 �� NaOH ��Һ��Ӧ�����ӷ���ʽ: _________________
���𰸡�Na2CO3=2Na++ CO32- �� 0.1 0.5 0.05 0.01 CO2+2OH-=CO32-+H2O CO2+OH-=HCO3-
��������
(1) ������̼���ƣ�ˮ��Һ�е������������Ӻ�̼������ӣ�
(2) ���̼���ƣ����ɽ��������Ӻ����������ɵĻ���������Σ�
(3) 10.6g��������ʵ���Ϊ![]() =0.1mol�����˹�������ˮ���200mL��Һ�������ʵ����ʵ���Ũ��Ϊ
=0.1mol�����˹�������ˮ���200mL��Һ�������ʵ����ʵ���Ũ��Ϊ![]() =0.5mol/L����ϡ�Ͷ��ɿɵã�0.5 mol/L ��10ml=c2��100ml��ϡ�ͺ����ʵ����ʵ���Ũ��c2=0.05mol/L��ϡ�ͺ���Һ�е�Na+���ʵ���Ϊ0.05 mol/L��0.1L��2=0.01mol��
=0.5mol/L����ϡ�Ͷ��ɿɵã�0.5 mol/L ��10ml=c2��100ml��ϡ�ͺ����ʵ����ʵ���Ũ��c2=0.05mol/L��ϡ�ͺ���Һ�е�Na+���ʵ���Ϊ0.05 mol/L��0.1L��2=0.01mol��
(4)��д������ CO2 �� NaOH ��Һ��Ӧ����̼���ƺ�ˮ��
��д������ CO2 �� NaOH ��Һ��Ӧ����̼�����ơ�
(1) ������̼���ƣ�ˮ��Һ�е������������Ӻ�̼������ӣ�����ķ���ʽ: Na2CO3=2Na+ + CO32-��
�ʴ�Ϊ��Na2CO3=2Na++CO32-��
(2) ���̼���ƣ����ɽ��������Ӻ����������ɵĻ���������Σ�
�ʴ�Ϊ���Σ�
(3) 10.6g��������ʵ���Ϊ![]() =0.1mol�����˹�������ˮ���200mL��Һ�������ʵ����ʵ���Ũ��Ϊ
=0.1mol�����˹�������ˮ���200mL��Һ�������ʵ����ʵ���Ũ��Ϊ![]() =0.5mol/L����ϡ�Ͷ��ɿɵã�0.5 mol/L ��10mL=c2��100mL��ϡ�ͺ����ʵ����ʵ���Ũ��c2=0.05mol/L��ϡ�ͺ���Һ�е�Na+���ʵ���Ϊ0.05 mol/L��0.1L��2=0.01mol��
=0.5mol/L����ϡ�Ͷ��ɿɵã�0.5 mol/L ��10mL=c2��100mL��ϡ�ͺ����ʵ����ʵ���Ũ��c2=0.05mol/L��ϡ�ͺ���Һ�е�Na+���ʵ���Ϊ0.05 mol/L��0.1L��2=0.01mol��
�ʴ�Ϊ��0.1��0.5��0.05��0.01��
(4)��д������ CO2 �� NaOH ��Һ��Ӧ����̼���ƺ�ˮ�����ӷ���ʽ: CO2+2OH-=CO32-+H2O��
�ʴ�Ϊ��CO2+2OH-=CO32-+H2O��
��д������ CO2 �� NaOH ��Һ��Ӧ����̼�����ƣ����ӷ���ʽ: CO2+OH-=HCO3-��
�ʴ�Ϊ��CO2+OH-=HCO3-��


 ��ѧ�����ϵ�д�
��ѧ�����ϵ�д� �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��VCB������ӵ�ص�һ-�����Ӽ�,�Ի�������(EO)Ϊԭ���Ʊ�VCB��һ�ֺϳ�·������:

����˵���������
A.��Ӧ�ٵ�ԭ��������Ϊ100%
B.�ڵķ�Ӧ����Ϊȡ����Ӧ.
C.EO��EC��һ�ȴ���������ͬ
D.CIEC��VCB����������ԭ�Ӿ�����ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LEDϵ�в�Ʒ�DZ����õ�һ������²�Ʒ,��ͼ��һ������ȼ�ϵ������LED�����װ�á������й�������ȷ����
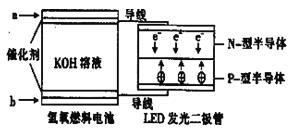
A��a��ͨ�������������˻�ԭ��Ӧ:H2-2e-+2OH-=2H2O
B��b��ͨ��������Ϊ��ص�����
C����װ����ֻ�漰������ʽ������ת��������е�KOH��ҺҲ����ϡ������Һ����
D��P-�Ͱ뵼�����ӵ��ǵ�ظ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�3.4 g NH3 �ģ���
A.������ԼΪ 6.02��1023B.���ʵ���Ϊ 0.1 mol
C.���ԼΪ 4.48 LD.��ԭ�ӵ����ʵ���Ϊ 0.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��ȷ����
A. �����ȼ������H����890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4(g)��2O2(g)=CO2(g)��2H2O(g) ��H����890.3kJ��mol��1
B. 500�桢30MPa�£���0.5molN2(g)��1.5mol H2(g)�����ܱ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪN2(g)��3H2(g)![]() 2NH3(g) ��H����38.6kJ��mol��1
2NH3(g) ��H����38.6kJ��mol��1
C. HCl��NaOH��Ӧ���к�����H��-57.3kJ��mol��1����H2SO4��Ca(OH)2��Ӧ���к�����H��2��(-57.3)kJ��mol��1
D. ��֪2C(s)��2O2(g)=2CO2(g) ��H��a��2C(s)��O2(g)=2CO(g) ��H��b����a<b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ti)����Ϊ��������֮��ĵ����������Ѱ�(TiO2)��Ŀǰ��õİ�ɫ���ϡ��Ʊ�TiO2��Ti��ԭ�����������ҹ�������������������λ���ú�Fe2O3��������(��Ҫ�ɷ�ΪFeTiO3)�Ʊ�TiO2�������£�

��֪��ӦTiO2++2H2O![]() H2TiO3+2H+ ��H<0
H2TiO3+2H+ ��H<0
��1����������Fe��Ŀ����___________________________________�������ӷ���ʽ�������������ȴ��Ŀ����_________________________________________________________��
��2�������Ʊ�TiO2�Ĺ����У��������õĸ�������__________________�����dzɱ��ͷ����ۺ��������أ���Һ��Ӧ����______�������ڡ�ˮ���������м��������ˮ���ɻ��H2TiO3������������ػ�ѧԭ������___________________________________________________��
��3���ɽ��ʯ(TiO2)��ȡ������(Ti)���漰���IJ���Ϊ
![]() �D��
�D��![]()
![]()
![]()
��ӦTiCl4��2Mg===2MgCl2��Ti��Ar�����н��е�������___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50 mL 0.50 mol��L1������50 mL 0.55 mol��L1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
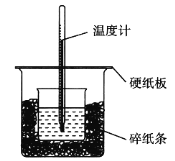
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��______________________________��
��2���ձ���������ֽ����������______________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ__________(����ƫ������ƫС��������Ӱ����)��
��4��ʵ���и���60 mL 0.50 mol��L1�����50 mL 0.55 mol��L1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������__________(��������������������)�������к���__________(��������������������)���������ɣ�_________________________��
��5������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��__________(����ƫ������ƫС��������Ӱ��������ͬ)����50 mL 0.50 mol��L1 NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��b��c��d�ĸ������缫��GΪ�����ơ��йصķ�Ӧװ�ü����ַ�Ӧ�������£�
ʵ��װ�� |
|
|
|
|
����ʵ������ | a��������С��b���������� | ��Һ�е�SO42-��b���ƶ� | d���ܽ�c����������� | ���Ӵ�d������a�� |
�ɴ˿��ж������ֽ����Ļ��˳����
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���a L�ܱ������м���1 mol X�����2 mol Y���壬�������·�Ӧ��X(g)+2Y(g)![]() 3Z(g)���˷�Ӧ�ﵽƽ��ı�־��
3Z(g)���˷�Ӧ�ﵽƽ��ı�־��
A. ������ѹǿ����ʱ��仯
B. �����ڸ����ʵ�Ũ�Ȳ���ʱ��仯
C. ������X��Y��Z��Ũ��֮��Ϊl��2��3
D. ��λʱ������0.1 mol Xͬʱ����0.3 mol Z
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com