
【题目】在标准状况下,3.4 g NH3 的()
A.分子数约为 6.02×1023B.物质的量为 0.1 mol
C.体积约为 4.48 LD.氢原子的物质的量为 0.2 mol
科目:高中化学 来源: 题型:
【题目】已知: M是人们日常生活中一种重要调料,也是一种重要的化工原料,在灼烧时,焰色反应呈黄色。A、B、D均为单质,在F的溶液中加入硫氰化钾溶液,溶液变成血红色,各物质的转化关系如下图所示:

根据以上信息回答下列问题:
(1)M和水发生电解的化学方程式____________。
(2)写出E溶于水的电离方程式__________。
(3)F和D反应生成G的离子方程式为____________。
(4)向G的溶液中滴加C的溶液,观察到的现象为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞共用。金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量(单位:g·mol-1)。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_________。
(3)一个晶胞的体积为________cm3。
(4)金晶体的密度为________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶于海水的CO2主要以4种无机碳形式存在,其中 HCO3-占95 % ,利用图示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法正确的是
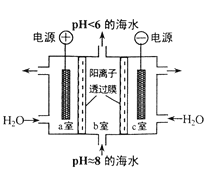
A. a 室排出的是NaOH 、Ca(OH)2等强碱性物质
B. 装置中产生的 O2和提取的 CO2的体积比约为1:4
C. c室发生的反应为 2H2O-4e-===O2↑+ 4H+
D. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2 II
CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
(备注)Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=___;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
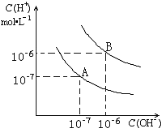
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,c(H+)=__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是生活中常见的物质,请回答下列问题:
(1)写出纯碱在水溶液中电离的方程式:_________。
(2)纯碱属于“酸”“碱”“盐”中的_____。
(3)现有 10.6 g 纯碱,其物质的量为__________mol,将此固体溶于水配成 200 mL 溶液,其溶质的物 质的量浓度为_________ mol·L-1,取出 10 mL 此溶液加水稀释至 100 mL,其溶质的物质的量浓度 为___ mol·L-1,稀释后溶液中 Na+的物质的量为________ mol。
(4)①写出少量 CO2 与 NaOH 溶液反应的离子方程式: _____________
②写出过量 CO2 与 NaOH 溶液反应的离子方程式: _________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 萘(![]() )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
)是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
B. 酚酞的结构如图所示,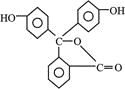 其结构中含有羟基(—OH),故酚酞属于醇
其结构中含有羟基(—OH),故酚酞属于醇
C. 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来
D. ![]() 的名称为2-甲基-4-戊醇
的名称为2-甲基-4-戊醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
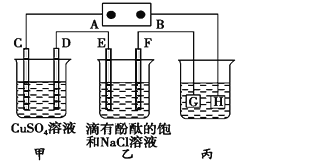
(1) A为电源的_____极,写出甲中C的电极反应式________。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__。
(3) 现用丙装置给铜件镀银,电镀液是______溶液。当乙中溶液的c(OH-)=0.1 molL1时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为___。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com