
【题目】已知: M是人们日常生活中一种重要调料,也是一种重要的化工原料,在灼烧时,焰色反应呈黄色。A、B、D均为单质,在F的溶液中加入硫氰化钾溶液,溶液变成血红色,各物质的转化关系如下图所示:

根据以上信息回答下列问题:
(1)M和水发生电解的化学方程式____________。
(2)写出E溶于水的电离方程式__________。
(3)F和D反应生成G的离子方程式为____________。
(4)向G的溶液中滴加C的溶液,观察到的现象为________。
【答案】2NaCl + 2H2O![]() 2NaOH + Cl2↑+ H2↑ HCl=H++Cl- 2Fe3+ + Fe=3Fe2+ 先有白色沉淀生成,后变为灰绿色,最终变为红褐色
2NaOH + Cl2↑+ H2↑ HCl=H++Cl- 2Fe3+ + Fe=3Fe2+ 先有白色沉淀生成,后变为灰绿色,最终变为红褐色
【解析】
M是人们日常生活中一种重要调料,也是一种重要的化工原料,在灼烧时,焰色反应呈黄色,则M是NaCl,电解NaCl的水溶液产物为H2、Cl2和NaOH,结合A、B、D均为单质,可知C为NaOH,E为HCl;在F的溶液中加入硫氰化钾溶液,溶液变成血红色,可知F为FeCl3,则A为Cl2、B为H2,D为Fe,G为FeCl2,据此分析解题。
由分析知:M为NaCl、A为Cl2、B为H2、C为NaOH、D为Fe、E为HCl、F为FeCl3、G为FeCl2;
(1)电解NaCl的水溶液发生的化学方程式为2NaCl + 2H2O![]() 2NaOH + Cl2↑+ H2↑;
2NaOH + Cl2↑+ H2↑;
(2)HCl溶于水电离出H+和Cl-,电离方程式为HCl=H++Cl-;
(3)Fe溶于FeCl3溶液生成FeCl2的离子方程式为2Fe3+ + Fe=3Fe2+;
(4)向FeCl2溶液中滴加NaOH的溶液,先有白色沉淀生成,因Fe(OH)2易被空气中氧气氧化成Fe(OH)3,则可继续观察到白色沉淀变为灰绿色,最终变为红褐色。


科目:高中化学 来源: 题型:
【题目】某温度下,饱和石灰水的溶解度为sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )
A. 最终得到沉淀的质量大于![]() g
g
B. 该饱和溶液质量百分比浓度为:![]() %
%
C. 最终所得溶液pH不变
D. 该饱和溶液中溶质物质的量浓度为:![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(In1-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]___;Ga、In、Se,第一电离能从大到小顺序为___。
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是___。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是___。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为___。
(4)SeO32-的立体构型为___;SeO2中硒原子采取杂化类型是___。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
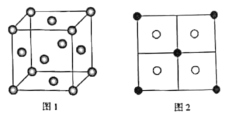
①CuS晶体中,相邻的两个铜离子间的距离为___pm。
②Cu2S晶体中,S2-的配位数为___。
③Cu2S晶体的密度为ρ=___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
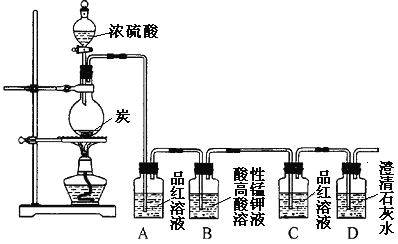
(1)烧瓶中发生反应的化学反应方程式是___________。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____,通过洗气瓶C中无现象和___的现象,证明反应有_______(填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______(填名称)具有______的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
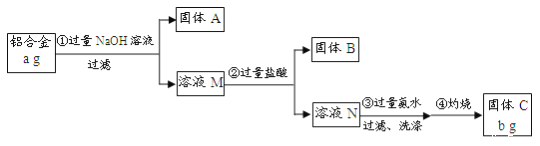
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2;2NaOH+SiO2=Na2SiO3+H2O;Na2SiO3+
2HCl=2NaCl+H2SiO3↓。
请回答下列问题:
(1)固体A的成分是_______;
(2)步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______。(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VCB是锂离子电池的一-种添加剂,以环氧乙烷(EO)为原料制备VCB的一种合成路线如下:

下列说法错误的是
A.反应①的原子利用率为100%
B.②的反应类型为取代反应.
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。其一种生产工艺如图所示。下列说法正确的是
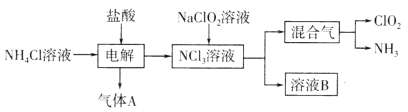
A.气体A为Cl2
B.参加反应的NaClO2和NCl3的物质的量之比为3:1
C.溶液B中含有大量的Na+、Cl-、OH-
D.可将混合气通过饱和食盐水除去C1O2中的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,3.4 g NH3 的()
A.分子数约为 6.02×1023B.物质的量为 0.1 mol
C.体积约为 4.48 LD.氢原子的物质的量为 0.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com