
°æƒø°øƒ≥Õ¨—ß”˚—È÷§Ãº”Î≈®¡ÚÀ·∑¥”¶≤˙ŒÔµƒ–‘÷ °£œ÷“—Ω´◊∞÷√»ÁÕº¡¨Ω”£¨«Îªÿ¥œ¬¡–Œ °£
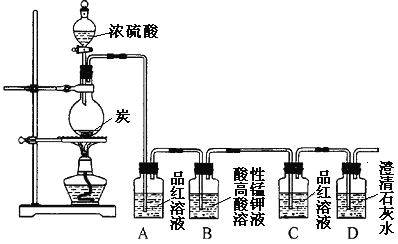
£®1£©…’∆ø÷–∑¢…˙∑¥”¶µƒªØ—ß∑¥”¶∑Ω≥Ã Ω «___________°£
£®2£© µ—È÷–¡Ω¥Œ π”√µΩ∆∑∫ϻГ∫£¨∆‰ƒøµƒ≤ªÕ¨°£Aµƒ π”√ƒøµƒ «_____£¨Õ®π˝œ¥∆¯∆øC÷–ŒÞœ÷œÛ∫Õ___µƒœ÷œÛ£¨÷§√˜∑¥”¶”–_______£®ÃÓªØ—ß Ω£©…˙≥…°£
£®3£©œ¥∆¯∆øB÷–»Ð“∫—’…´±‰«≥£¨Àµ√˜Ãº”Î≈®¡ÚÀ·∑¥”¶µƒ≤˙ŒÔ÷Æ“ª______£®ÃÓ√˚≥∆£©æþ”–______µƒ–‘÷ °£
£®4£© µ—ÈÕÍ≥…∫Û£¨»°≥ˆœ¥∆¯∆øA÷–µƒŒÞ…´»Ð“∫”⁄ ‘πÐ÷–£¨º”»»£¨ø…π€≤ϵΩ__________°£
°æ¥∞∏°øC+2H2SO4(≈®)![]() CO2°¸+2SO2°¸+2H2O ºÏ—È∑¥”¶÷–”–SO2∆¯ÃÂ…˙≥… ≥Œ«Â ت“ÀƱ‰ªÎ◊« CO2 SO2 ªπ‘≠–‘ ŒÞ…´»Ð“∫”÷ª÷∏¥∫Ï…´
CO2°¸+2SO2°¸+2H2O ºÏ—È∑¥”¶÷–”–SO2∆¯ÃÂ…˙≥… ≥Œ«Â ت“ÀƱ‰ªÎ◊« CO2 SO2 ªπ‘≠–‘ ŒÞ…´»Ð“∫”÷ª÷∏¥∫Ï…´
°æΩ‚Œˆ°ø
≈®¡ÚÀ·µƒ«ø—ıªØ–‘£¨º”»»Ãıº˛œ¬ƒÐπªΩ´ƒæÃø—ıªØ≥……˙≥…CO2°¢SO2∫ÕÀÆ£¨Ω´∑¥”¶∫ÛµƒªÏ∫œ∆¯Ã“¿¥ŒÕ®π˝A◊∞÷√£¨∆∑∫ÏÕ …´£¨Àµ√˜”–SO2∆¯ÃÂ…˙≥…£¨Õ®π˝B÷–À·–‘∏þ√ÃÀ·ºÿ»Ð“∫£¨¿˚”√SO2µƒªπ‘≠–‘£¨≥˝»•SO2£¨‘ŸÕ®π˝C÷–∆∑∫Ï ±£¨∆∑∫Ï≤ªÕ …´£¨Àµ√˜SO2“—æ≠ÕÍ»´≥˝»•£¨‘ŸÕ®π˝≥Œ«Â ت“ÀÆ£¨ ت“ÀƱ‰ªÎ◊«£¨Àµ√˜”–CO2∆¯ÃÂ…˙≥…°£
(1)≈®¡ÚÀ·æþ”–«ø—ıªØ–‘£¨‘⁄º”»»µƒÃıº˛œ¬£¨ƒÐ∞—ƒæÃø—ıªØ…˙≥…CO2°¢SO2∫ÕÀÆ£¨∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™£∫C+2H2SO4(≈®)![]() CO2°¸+2SO2°¸+2H2O£ª
CO2°¸+2SO2°¸+2H2O£ª
(2)A÷–∆∑∫ÏÕ …´£¨ø…ºÏ—È∑¥”¶÷–”–SO2∆¯ÃÂ…˙≥…£ªæ≠π˝B◊∞÷√÷–À·–‘∏þ√ÃÀ·ºÿ»Ð“∫≥˝»•SO2∫Û£¨ø…Õ®π˝œ¥∆¯∆øC÷–∆∑∫Ï≤ªÕ …´∫ÕD÷–≥Œ«Â ت“ÀƱ‰ªÎ◊«£¨÷§√˜∑¥”¶”–CO2…˙≥…£ª
(3)œ¥∆¯∆øB÷–À·–‘∏þ√ÃÀ·ºÿ»Ð“∫—’…´±‰«≥£¨Àµ√˜Ãº”Î≈®¡ÚÀ·∑¥”¶µƒ≤˙ŒÔ÷Æ“ªSO2æþ”–ªπ‘≠–‘£ª
(4)“ÚSO2”Î∆∑∫Ï…˙≥…¡À≤ªŒ»∂®µƒŒÞ…´ŒÔ÷ £¨‘ÚA÷–∆∑∫ϻГ∫Õ …´∫Û£¨‘Ÿº”»»£¨»Ð“∫”÷ª÷∏¥∫Ï…´°£


 ‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»ÁÕº«˙œþa±Ì æø…ƒÊ∑¥”¶X£®g£©+Y£®g£©Z£®g£©+M£®g£©£ÆΩ¯––π˝≥Ã÷–ZµƒŒÔ÷ µƒ¡øÀÊ ±º‰±‰ªØµƒπÿœµ£Æ»Ù“™∏ƒ±‰∆ ºÃıº˛£¨ π∑¥”¶π˝≥Ã∞¥b«˙œþΩ¯––£¨ø…≤…»°µƒ¥Î © «£® £©
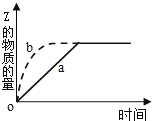
A£Æ—πÀı∑¥”¶»ð∆˜µƒÃª˝
B£Æº”»Î“ª∂®¡øµƒZ
C£ÆΩµµÕŒ¬∂»
D£Æºı…ŸXµƒÕ∂»Î¡ø
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø““À·““ı•π„∑∫”√”⁄“©ŒÔ°¢»º¡œ°¢œ„¡œµ»π§“µ£¨‘⁄÷–—ßªØ—ß µ—È “¿Ô≥£”√»ÁÕº◊∞÷√¿¥÷∆±∏““À·““ı•°£![]() ≤ø∑÷º–≥÷“«∆˜“—¬‘»•
≤ø∑÷º–≥÷“«∆˜“—¬‘»•![]()
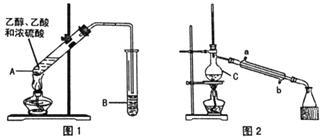
“—÷™£∫
√Ð∂»(g/cm3) | »€µ„(°Ê) | ∑–µ„(°Ê) | »ÐΩ‚∂» | |
““¥º | 0.79 | -114.5 | 78.4 | ”ÎÀƪ•»Ð |
““À· | 1.05 | 16.6 | 118.1 | “◊»Ð”⁄ÀÆ°¢““¥º |
““À·““ı• | 0.90 | -83.6 | 77.2 | Œ¢»Ð”⁄ÀÆ£¨ƒÐ»Ð”⁄““¥º |
¢Ò÷∆±∏¥÷∆∑(Õº1)
‘⁄A÷–º”»Î…Ÿ¡øÀÈ¥…∆¨£¨Ω´»˝÷÷‘≠¡œ“¿¥Œº”»ÎA÷–£¨”√æ∆æ´µ∆ª∫¬˝º”»»£¨“ª∂Œ ±º‰∫Û‘⁄B÷–µ√µΩ““À·““ı•¥÷∆∑°£
£®1£©≈®¡ÚÀ·°¢““¥º°¢““À·µƒº”»ÎÀ≥–Ú «___£¨A÷–∑¢…˙∑¥”¶µƒªØ—ß∑Ω≥Ã Ω «___°£
£®2£©A÷–ÀÈ¥…∆¨µƒ◊˜”√ «___£¨≥§µºπÐ≥˝¡Àµº∆¯Õ‚£¨ªπæþ”–µƒ◊˜”√ «___°£
£®3£©B÷– ¢◊∞µƒ“∫à«___£¨ ’ºØµΩµƒ““À·““ı•‘⁄___≤„(ÃÓ°∞…œ°±ªÚ°∞œ¬°±)°£
¢Ú.÷∆±∏æ´∆∑(Õº2)
Ω´B÷–µƒ“∫ÃÂ∑÷“∫£¨∂‘““À·““ı•¥÷∆∑Ω¯––“ªœµ¡–≥˝‘”≤Ÿ◊˜∫Û◊™“∆µΩC÷–£¨¿˚”√Õº2◊∞÷√Ω¯“ª≤Ω≤Ÿ◊˜º¥µ√µΩ““À·““ı•æ´∆∑°£
£®4£©Cµƒ√˚≥∆ «___°£
£®5£© µ—Èπ˝≥Ã÷–£¨¿‰»¥ÀÆ¥”___ø⁄Ω¯»Î(ÃÓ◊÷ƒ∏)£ª ’ºØ≤˙∆∑ ±£¨øÿ÷∆µƒŒ¬∂»”¶‘⁄___◊Û”“°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–∑¥”¶µƒ¿Î◊”∑Ω≥à Ω÷–£¨ È–¥’˝»∑µƒ «
A.¬»∆¯»Ð”⁄ÀÆ£∫H2O+Cl2=2H++Cl£≠+ClO£≠
B.Ω´¬¡∑€Õ∂»Î«‚—ıªØƒ∆»Ð“∫÷–£∫2Al+2OH£≠+2H2O=2AlO2£≠+H2°¸
C.Ω´–°À’¥Ú∫Õ…’ºÓ¡Ω»Ð“∫ªÏ∫œ£∫HCO3£≠+OH-=H2O+CO32£≠
D. Ø”¢»Ð”⁄NaOH»Ð“∫£∫Si4++2O2£≠+2OH£≠=SiO32£≠+H2O
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥—–æø–°◊È“‘±Ω““œ©∫Õ““œ©Œ™÷˜“™‘≠¡œ£¨…˺∆≥ˆ“Ω“©÷–º‰ÃÂGµƒ∫œ≥…¬∑œþ»ÁÕº£∫
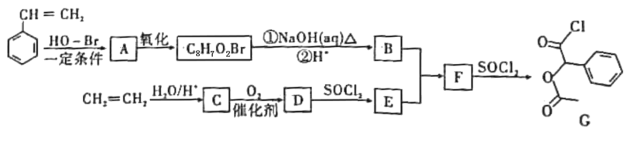
“—÷™RCOOH![]() RCOCl
RCOCl![]() RCOOR°Ø°£
RCOOR°Ø°£
£®1£©B÷–∫¨—ıπŸƒÐÕ≈µƒ√˚≥∆Œ™___£ªDµƒΩ·ππºÚ ΩŒ™___°£
£®2£©““œ©µƒƒ≥÷÷Õ¨œµŒÔµƒªØ—ß√˚≥∆Œ™°∞º◊ª˘±˚œ©°±£¨‘Úº◊ª˘±˚œ©µƒΩ·ππºÚ ΩŒ™___°£
£®3£©BƒÐÕ®π˝∑÷◊”º‰Õ—ÀÆ…˙≥…”–ª˙ŒÔX£¨Xø…”√”⁄œ„¡œ£¨∆‰Ω·ππ÷–∫¨”–»˝∏ˆ¡˘‘™ª∑◊¥Ω·π𣨑ÚB◊™ªØŒ™XµƒªØ—ß∑Ω≥Ã Ω£∫___°£
£®4£©M «GµƒÕ¨∑÷“Ïππã¨∑˚∫œœ¬¡–Ω·ππ∫Õ–‘÷ µƒ∑ºœ„◊ªØ∫œŒÔMπ≤”–___÷÷£®≤ªøº¬«¡¢Ã“Ïπ𣩰£
¢Ÿ1molM”Γ¯∞±»Ð“∫∑¥”¶◊Ó∂ýƒÐµ√4molAg£ª
¢⁄±Ωª∑…œ”–Àƒ∏ˆ»°¥˙ª˘£¨∆‰œý∂‘Œª÷√Œ™![]() £ª
£ª
¢€∫À¥≈π≤’Ò«‚∆◊Œ™5◊È∑£¨«“∑Â√ʪ˝Œ™2£∫2£∫2£∫2£∫1£ª
¢ÐMƒÐ∑¢…˙œ˚»•∑¥”¶°£
–¥≥ˆM∑¢…˙œ˚»•∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫___£®“ª¿˝º¥ø…£©°£
£®5£©…˺∆≥ˆ“‘º◊±ΩŒ™‘≠¡œ÷∆±∏Bµƒ∫œ≥…¬∑œþ£®ŒÞª˙ ‘º¡»Œ—°£¨“—÷™£∫RCHO![]()
![]() £¨RCN
£¨RCN![]() RCOOH£©___°£
RCOOH£©___°£
∫œ≥…¬∑œþ≥£”√µƒ±Ì æ∑Ω ΩŒ™£∫A![]() B°≠°≠
B°≠°≠![]() ƒø±Í≤˙ŒÔ°£
ƒø±Í≤˙ŒÔ°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™£∫ M «»À√«»’≥£…˙ªÓ÷–“ª÷÷÷ÿ“™µ˜¡œ£¨“≤ «“ª÷÷÷ÿ“™µƒªØπ§‘≠¡œ£¨‘⁄◊∆…’ ±£¨—Ê…´∑¥”¶≥ ª∆…´°£A°¢B°¢Dæ˘Œ™µ•÷ £¨‘⁄Fµƒ»Ð“∫÷–º”»Î¡Ú«ËªØºÿ»Ð“∫£¨»Ð“∫±‰≥…—™∫Ï…´£¨∏˜ŒÔ÷ µƒ◊™ªØπÿœµ»Áœ¬ÕºÀ˘ æ£∫

∏˘æð“‘…œ–≈œ¢ªÿ¥œ¬¡–Œ £∫
£®1£©M∫ÕÀÆ∑¢…˙µÁΩ‚µƒªØ—ß∑Ω≥à Ω____________°£
£®2£©–¥≥ˆE»Ð”⁄ÀƵƒµÁ¿Î∑Ω≥à Ω__________°£
£®3£©F∫ÕD∑¥”¶…˙≥…Gµƒ¿Î◊”∑Ω≥Ã ΩŒ™____________°£
£®4£©œÚGµƒ»Ð“∫÷–µŒº”Cµƒ»Ð“∫£¨π€≤ÏµΩµƒœ÷œÛŒ™________°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∂˛—ıªØµ™ø…”…NO∫ÕO2…˙≥…£¨“—÷™‘⁄2L√б’»ð∆˜ƒ⁄£¨800°Ê ±∑¥”¶£∫2NO(g)£´O2(g)![]() 2NO2(g) ¶§H£¨n(NO)°¢n(O2)ÀÊ ±º‰µƒ±‰ªØ»Á±Ì£∫
2NO2(g) ¶§H£¨n(NO)°¢n(O2)ÀÊ ±º‰µƒ±‰ªØ»Á±Ì£∫
±º‰/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
£®1£©“—÷™£∫K800°Ê>K1000°Ê£¨‘Ú∏√∑¥”¶µƒ¶§H___0(ÃÓ°∞¥Û”⁄°±ªÚ°∞–°”⁄°±)£¨”√O2±Ì æ0°´2 sƒ⁄∏√∑¥”¶µƒ∆Ωæ˘ÀŸ¬ Œ™___°£
£®2£©ƒÐÀµ√˜∏√∑¥”¶“—¥ÔµΩ∆Ω∫‚◊¥Ã¨µƒ «___°£
a£Æ»ð∆˜ƒ⁄∆¯Ã—’…´±£≥÷≤ª±‰ b£Æ2vƒÊ(NO)£Ωv’˝(O2)
c£Æ»ð∆˜ƒ⁄—π«ø±£≥÷≤ª±‰ d£Æ»ð∆˜ƒ⁄∆¯ÃÂ√Ð∂»±£≥÷≤ª±‰
£®3£©Œ™ π∏√∑¥”¶µƒÀŸ¬ ‘ˆ¥Û£¨Ã·∏þNOµƒ◊™ªØ¬ £¨«“∆Ω∫‚œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø£¨”¶≤…»°µƒ¥Î ©”–_____°£
£®4£©‘⁄ ˆÃıº˛œ¬£¨º∆À„Õ®»Î2molNO∫Õ1molO2µƒ∆Ω∫‚≥£ ˝K£Ω___°£
£®5£©‘⁄ ˆÃıº˛œ¬£¨»Ùø™ ºÕ®»Îµƒ «0.2molNO2∆¯Ã£¨¥ÔµΩªØ—ß∆Ω∫‚ ±£¨NO2µƒ◊™ªØ¬ Œ™__°£
£®6£©√∫»º…’≤˙…˙µƒ—Ã∆¯∫¨µ™µƒ—ıªØŒÔ£¨”√CH4¥þªØªπ‘≠NOxø…“‘œ˚≥˝µ™—ıªØŒÔµƒŒ€»æ°£
¢ŸCH4(g)£´4NO(g)![]() 2N2(g)£´CO2(g)£´2H2O ¶§H<0
2N2(g)£´CO2(g)£´2H2O ¶§H<0
¢⁄CH4(g)£´2NO2(g)![]() N2(g)£´CO2(g)£´2H2O(g) ¶§H<0
N2(g)£´CO2(g)£´2H2O(g) ¶§H<0
∂‘”⁄∑¥”¶¢⁄£¨”˚÷∏þNO2µƒ◊™ªØ¬ £¨ø…≤…»°µƒ¥Î ©”–____°£
a£Æ‘ˆº”‘≠¥þªØº¡µƒ±Ì√ʪ˝ b£ÆΩµµÕŒ¬∂» c£Æºı–°Õ∂¡œ±»[n(NO2)/n(CH4)] d£Æ‘ˆ¥Û—π«ø
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∂˛—ıªØπËæßà«¡¢ÃµƒÕ¯◊¥Ω·ππ£¨∆‰æßÃÂΩ·ππƒ£–Õ»ÁÕº°£«Î»œ’Êπ€≤Ï∏√ƒ£–Õ∫Ûªÿ¥œ¬¡–Œ £∫
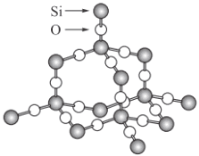
(1)∂˛—ıªØπËæßÃÂ÷–◊Ó–°ª∑…œ”–______∏ˆ‘≠◊”£¨æßÃÂΩ·ππ÷–¥Ê‘⁄“‘__________‘≠◊”Œ™÷––ƒ°¢________‘≠◊”Œ™∂•µ„µƒ’˝Àƒ√ÊÃÂΩ·ππ°£
(2)æßÃÂ÷–¥Ê‘⁄µƒ◊˜”√¡¶”–________°£
A£Æπ≤º€º¸°°B£Æ¿Î◊”º¸°°C£Æ≈‰Œªº¸°°D£Æ∑∂µ¬ª™¡¶°°E£Æ«‚º¸
(3)√¿π˙LawreceLiremoreπ˙º“ µ—È “(LLNL)µƒV.Lota.C.S.Yoo∫ÕCynn≥…π¶µÿ‘⁄∏þ—πœ¬Ω´CO2◊™ªØŒ™æþ”–¿ýÀ∆SiO2Ω·π𵃑≠◊”æß㨜¬¡–πÿ”⁄CO2µƒ‘≠◊”æßÃÂÀµ∑®’˝»∑µƒ «________°£
A£ÆCO2µƒ‘≠◊”æßÃÂ∫Õ∑÷◊”æßê•Œ™Õ¨Àÿ“Ï–ŒÃÂ
B£Æ‘⁄“ª∂®Ãıº˛œ¬£¨CO2‘≠◊”æßÃÂ◊™ªØŒ™∑÷◊”æßૌԿ̱‰ªØ
C£ÆCO2µƒ‘≠◊”æßÃÂ∫ÕCO2µƒ∑÷◊”æßÃÂæþ”–œýÕ¨µƒŒÔ¿Ì–‘÷
D£Æ‘⁄CO2µƒ‘≠◊”æßÃÂ÷–£¨√ø∏ˆC‘≠◊”Ω·∫œ4∏ˆO‘≠◊”£¨√ø∏ˆO‘≠◊”Ω·∫œ¡Ω∏ˆC‘≠◊”
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¥þªØªπ‘≠CO2 «Ω‚戌¬ “–ß”¶º∞ƒÐ‘¥Œ µƒ÷ÿ“™ ÷∂Œ÷Æ“ª°£—–æø±Ì√˜£¨‘⁄Cu/ZnO¥þªØº¡¥Ê‘⁄œ¬£¨CO2∫ÕH2ø…∑¢…˙¡Ω∏ˆ∆Ω––∑¥”¶£¨∑÷±…˙≥…CH3OH∫ÕCO°£∑¥”¶µƒ»»ªØ—ß∑Ω≥Ã Ω»Áœ¬£∫
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ¶§H1=-53.7kJ°§mol-1 I
CH3OH(g)+H2O(g) ¶§H1=-53.7kJ°§mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) ¶§H2 II
CO(g)+H2O(g) ¶§H2 II
ƒ≥ µ—È “øÿ÷∆CO2∫ÕH2≥ı ºÕ∂¡œ±»Œ™1£∫2.2£¨‘⁄œýÕ¨—π«øœ¬£¨æ≠π˝œýÕ¨∑¥”¶ ±º‰≤‚µ√»Áœ¬ µ—È ˝æð£∫
T(K) | ¥þªØº¡ | CO2◊™ªØ¬ £®%£© | º◊¥º—°‘Ò–‘£®%£© |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
£®±∏◊¢£©Cat.1£∫Cu/ZnOƒ…√◊∞Ù£ªCat.2£∫Cu/ZnOƒ…√◊∆¨£ªº◊¥º—°‘Ò–‘£∫◊™ªØµƒCO2÷–…˙≥…º◊¥ºµƒ∞Ÿ∑÷±»
“—÷™£∫¢ŸCO∫ÕH2µƒ±Í◊º»º…’»»∑÷±Œ™-283.0kJ°§mol-1∫Õ-285.8kJ°§mol-1
¢⁄H2O(l)=H2O(g) ¶§H3=44.0kJ°§mol-1
«Îªÿ¥£®≤ªøº¬«Œ¬∂»∂‘¶§Hµƒ”∞œÏ£©£∫
(1)∑¥”¶Iµƒ∆Ω∫‚≥£ ˝±Ì¥Ô ΩK=___£ª
(2)”–¿˚”⁄÷∏þCO2◊™ªØŒ™CH3OH∆Ω∫‚◊™ªØ¬ µƒ¥Î ©”–___°£
A£Æ π”√¥þªØº¡Cat.1
B£Æ π”√¥þªØº¡Cat.2
C£ÆΩµµÕ∑¥”¶Œ¬∂»
D£ÆÕ∂¡œ±»≤ª±‰£¨‘ˆº”∑¥”¶ŒÔµƒ≈®∂»
E£Æ‘ˆ¥ÛCO2∫ÕH2µƒ≥ı ºÕ∂¡œ±»
(3)±Ì÷– µ—È ˝æð±Ì√˜£¨‘⁄œýÕ¨Œ¬∂»œ¬≤ªÕ¨µƒ¥þªØº¡∂‘CO2◊™ªØ≥…CH3OHµƒ—°‘Ò–‘”–œ‘÷¯µƒ”∞œÏ£¨∆‰‘≠“Ú «___°£
(4)‘⁄Õº÷–∑÷±ª≠≥ˆ∑¥”¶I‘⁄ŒÞ¥þªØº¡°¢”–Cat.1∫Õ”–Cat.2»˝÷÷«Èøˆœ¬°∞∑¥”¶π˝≥ð´ƒÐ¡ø°± æ“‚Õº___°£

≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com