
【题目】二氧化氮可由NO和O2生成,已知在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH___0(填“大于”或“小于”),用O2表示0~2 s内该反应的平均速率为___。
(2)能说明该反应已达到平衡状态的是___。
a.容器内气体颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有_____。
(4)在题述条件下,计算通入2molNO和1molO2的平衡常数K=___。
(5)在题述条件下,若开始通入的是0.2molNO2气体,达到化学平衡时,NO2的转化率为__。
(6)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O ΔH<0
2N2(g)+CO2(g)+2H2O ΔH<0
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH<0
N2(g)+CO2(g)+2H2O(g) ΔH<0
对于反应②,欲提高NO2的转化率,可采取的措施有____。
a.增加原催化剂的表面积 b.降低温度 c.减小投料比[n(NO2)/n(CH4)] d.增大压强
【答案】小于 0.015mol·L-1·s-1 ac 通入氧气、增大压强(缩小容器体积) 720 25% bc
【解析】
(1)根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动;依据速率公式计算可得;
(2) 在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,利用化学平衡状态的特征“等”、“定”来判断反应达到平衡状态;
(3) 该反应是一个气体体积减小的放热反应;
(4)化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变,则可以利用题给表格数据计算化学平衡常数;
(5)在题述条件下,若开始通入的是0.2molNO2气体,与题给表格数据为等效平衡;
(6)依据化学平衡移动原理分析判断。
(1)根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,由K800℃>K1000℃可知,升高温度,化学平衡常数减小,说明升高温度,平衡向逆反应方向移动,则该反应的正反应为放热反应,即ΔH<0;从0~2 s内用O2表示该反应的平均速率为v(O2)=![]() =0.015mol/(L·s),故答案为:小于;0.015mol·L-1·s-1;
=0.015mol/(L·s),故答案为:小于;0.015mol·L-1·s-1;
(2)a、该反应是在恒容的密闭容器中发生的,只有NO2是红棕色,其它气体都是无色的,若容器内颜色保持不变,说明各种气体的物质的量不变,表明反应达到平衡状态,故正确;
b、在任何时刻都存在关系:2v逆(NO)=v正(O2),不能表明反应达到平衡状态,故错误;
c、该反应是一个气体体积减小的反应,容器内压强保持不变,说明正逆反应速率相等,该反应达到了平衡状态,故正确;
d、由质量守恒定律可知,反应前后气体的质量不变,容器的容积也不变,所以任何时刻容器内气体的密度都保持不变,容器内气体密度保持不变不可作为判断平衡的标志,故错误;
ac正确,故答案为:ac;
(3) 该反应是一个气体体积减小的放热反应,为使该反应的反应速率增大,提高NO的转化率,且平衡向正反应方向移动,则应采取的措施为通入氧气来增大氧气的浓度或增大体系的压强,故答案为:通入氧气、增大压强(缩小容器体积);
(4)化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变,则可以利用题给表格数据计算化学平衡常数,由表格数据可知,平衡时,NO、O2和NO2的浓度为0.025mol/L、0.0125mol/L和0.075mol/L,平衡常数K=![]() =
=![]() =720,故答案为:720;
=720,故答案为:720;
(5)在题述条件下,若开始通入的是0.2molNO2气体,与题给表格数据为等效平衡,平衡时,各物质的浓度与表格中平衡时的效果是一样的。平衡时NO2的浓度为0.075mol/L,体积为2L,物质的量为0.075mol/L×2=0.15mol,则NO2的转化率为(0.2-0.15)/2=0.25;
也可以利用平衡常数求解。设在反应过程中c(O2)为xmol/L,则平衡时各种物质的浓度分别是c(NO2)=(0.1-2x)mol/L,c(NO)=2xmol/L,c(O2)=xmol/L,由化学平衡常数可得![]() =720,解得x=0.0125mol/L,则NO2的转化率为
=720,解得x=0.0125mol/L,则NO2的转化率为![]() ×100%=25%,故答案为:25%;
×100%=25%,故答案为:25%;
(6)反应②为一个气体体积增加的放热反应。
a、增加原催化剂的表面积,反应速率加快,化学平衡不移动,二氧化氮转化率不变,故错误;
b、降低温度,平衡向正反应方向移动,二氧化氮转化率增大,故正确;
c、减小投料比![]() ,相当于二氧化氮浓度不变,增大甲烷的浓度,增大甲烷浓度,平衡向正反应方向移动,甲烷转化率减小,二氧化氮转化率增大,故正确;
,相当于二氧化氮浓度不变,增大甲烷的浓度,增大甲烷浓度,平衡向正反应方向移动,甲烷转化率减小,二氧化氮转化率增大,故正确;
d、增大压强,平衡向逆反应方向移动,二氧化氮转化率减小,故错误;
bc正确,故答案为:bc。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:

下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是常用的氨化剂之一。某研究小组利用反应原理:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH<0制备氨基甲酸铵,其装置如图所示,已知:H2NCOONH4(s)白色固体,易分解、易水解。则下列观点不正确的是( )
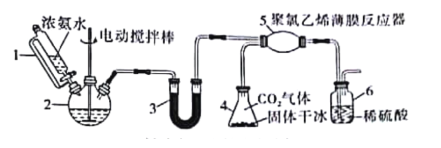
A.仪器1是恒压漏斗,该实验用于防倒吸
B.仪器2和仪器3都可以放置NaOH固体
C.为了完成实验,应在装置5和6之间,依次添加干燥装置和安全瓶
D.若反应初期观察到装置6内稀硫酸溶液中产生气泡,应控制旋塞,加大浓氨水的流速
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
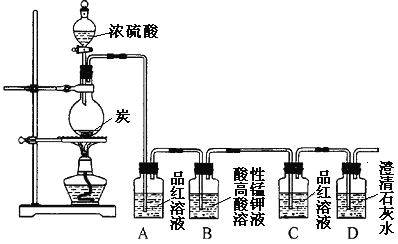
(1)烧瓶中发生反应的化学反应方程式是___________。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____,通过洗气瓶C中无现象和___的现象,证明反应有_______(填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______(填名称)具有______的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
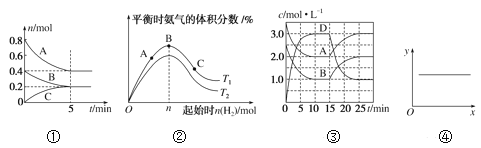
A. ①反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
C. ③A(g)+B(g)![]() C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
D. ④2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VCB是锂离子电池的一-种添加剂,以环氧乙烷(EO)为原料制备VCB的一种合成路线如下:

下列说法错误的是
A.反应①的原子利用率为100%
B.②的反应类型为取代反应.
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:
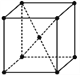
(1) 每一个晶胞中分摊到________个钨原子。
(2) 计算晶胞的边长a_____。
(3) 计算钨的原子半径r_____ (提示:只有体对角线上的各个球才是彼此接触的)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质
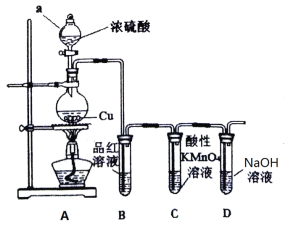
请回答:
(1)图中仪器a的名称为_____________。
(2)A中发生反应的化学方程式是_____________________________________。
(3)若C中溶液褪色,体现SO2具有_________________性。
(4)过量NaOH溶液与SO2反应的离子方程式是__________________________________。
(5)向两支装有品红溶液的试管中,分别通入Cl2和SO2,发现两支试管中品红溶液均褪色,请你设计实验证明哪支试管中通入的是SO2:_________________。
(6)该小组继续设计实验,相同条件下将Cl2和SO2两种气体按体积1:1混合,再通入品红溶液中,观察溶液几乎不褪色。查阅资料知:两种气体按体积1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com