
【题目】如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
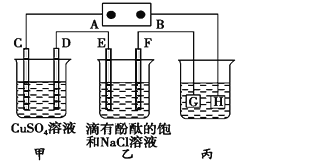
(1) A为电源的_____极,写出甲中C的电极反应式________。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__。
(3) 现用丙装置给铜件镀银,电镀液是______溶液。当乙中溶液的c(OH-)=0.1 molL1时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为___。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是________。
【答案】正极 4OH--4e-=O2↑+2H2O 1∶2∶2∶2 AgNO3 5.4 g 2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑
2OH- + H2↑ + Cl2↑
【解析】
(1) 将直流电源接通后,F极附近呈红色,说明F电极为阴极,阴极上氢离子放电导致F电极附近呈碱性,则C、E、G为阳极,D、F、H为阴极,阴极连接原电池负极,所以B是原电池负极;阳极连接原电池正极,所以A是原电池正极;C与电源正极相连,C为阳极,阳极上溶液中的阴离子失电子发生氧化反应,根据放电顺序,氢氧根离子在阳极放电产生氧气和水,电极式为:4OH--4e-=O2↑+2H2O
故答案为:正极;4OH--4e-=O2↑+2H2O
(2) C、D、E、F发生的反应分别为:4OH--4e-=2H2O+O2↑、Cu2++2e-=Cu、2Cl--2e-=Cl2↑、2H++2e-=H2↑,串联电路中转移电子相等,假设都转移4mol电子时,O2、Cu、Cl2、H2的物质的量分别是1mol、2mol、2mol、2mol,所以生成单质的物质的量之比为1:2:2:2,
故答案为:1:2:2:2;
(3) 用丙装置给铜件镀银,镀层Ag为阳极,则G为Ag,镀件H为阴极,阴极材料H是Cu,电镀液为AgNO3溶液,当乙中溶液的c(OH-)=0.1molL-1时(此时乙溶液体积为500mL),根据电极反应2H2O+2e-═H2↑+2OH-,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,
故答案为: AgNO3;5.4g;
(4) 若将F换为Fe,铁做阴极提供电子,不参与电极反应,乙装置中电极反应不变,阳极上溶液中的氯离子失电子变为氯气,阴极上氢离子得到电子产生氢气和氢氧根离子,乙中发生总反应的离子方程式为2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑;
2OH- + H2↑ + Cl2↑;
答案为2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑。
2OH- + H2↑ + Cl2↑。


科目:高中化学 来源: 题型:
【题目】在标准状况下,3.4 g NH3 的()
A.分子数约为 6.02×1023B.物质的量为 0.1 mol
C.体积约为 4.48 LD.氢原子的物质的量为 0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
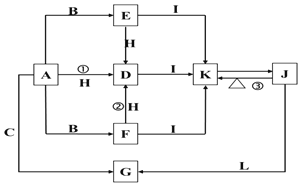
请按要求书写:
(1)反应①的离子方程式: ____________________________________;
(2)物质K与物质L等物质的量离子方程式:___________________________;
(3)物质F转化为D的离子方程式:___________________________________;
(4)物质G向物质J转化的化学方程式:_______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
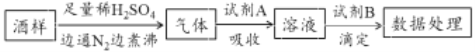
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 3Z(g)。此反应达到平衡的标志是
3Z(g)。此反应达到平衡的标志是
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l∶2∶3
D. 单位时间消耗0.1 mol X同时生成0.3 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2= 2Fe3++2H2O
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
C. 铁和稀硝酸反应:Fe+ 2H+=Fe2++ H2↑
D. 硫酸氢钠溶液中逐滴加入氢氧化钡溶液直至溶液呈中性: H++ SO42- + OH-+ Ba2+ = BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )
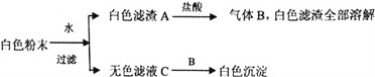
A.BaCl2、CaCO3一定存在,NaOH可能存在
B.K2SO4、CuSO4一定不存在
C.K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在
D.C为单一溶质溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com