
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
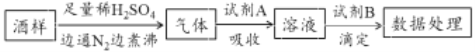
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、E为家庭中常见有机化合物,A与高锰酸钾酸性溶液反应可生成B,D是石油化工发展水平的标志,E是一种常见的高分子材料。根据下面的转化关系回答下列问题:
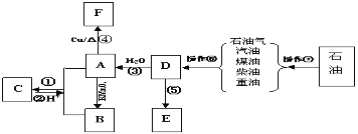
(1)D的结构简式为:_____________。
(2)B中官能团的名称为:______________。
(3)在①~⑤中属于氧化反应的是_________;属于加成反应的是________。(填序号)
(4)写出下列反应方程式:反应①________________________;
反应④_________________________。
(5)用A、B制备物质C时,除去C中含有的杂质选择的试剂及操作分别为___________,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)砷是第四周期VA族元素。下列关于第VA族元素及其化合物的说法不正确的是_______(填序号)。
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的AsH3;
②AsH3与AgNO3溶液反应产生As2O3与另一种固体,该反应的离子方程式为_____________。
(3)砷及其化合物几乎都有毒,通常+3价砷化合物毒性强于+5价砷化合物。海产品中含有微量+5价砷化合物,食用海鲜后不能马上进食水果的原因是________________________________。
(4)砷酸(H3AsO4)可用于制造杀虫剂、药物。As2O3溶于稀硝酸中可得砷酸,此反应的化学方程式为________________________________。
(5)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[Fe(OH)3和FeOOH],吸附沉降砷的化合物。在其它条件一定时,调节水样的pH,得到除砷效率曲线如图所示。
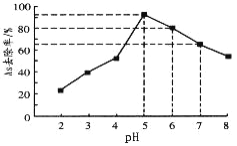
①请解释水样酸性较强时,除砷效率较低的原因是_____________________。
②国家饮用水标准规定水中砷的含量应低于0.05mg·L-1(1mg=1000μg)。某水样中含砷总浓度为100μg·L-1,若控制水样的pH=6,出水后的砷浓度_________________(填“能”或“否”)达到饮用水标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F、Cl和Br都是VIIA族元素,关于这三种元素原子说法正确的是
A.原子半径:F>C1>BrB.最外层电子数都相同
C.核外电子层数都相同D.最外层电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法不正确的是
A. 100mL l mol·L-1KClO溶液中,阴离子的数目大于0.1NA
B. 14g乙烯和丙烯混合气体中含有C—H共价键的数目为2NA
C. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
D. 含0.4molHNO3的浓硝酸与足量铜反应,转移的电子数等于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )

①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔
A. ①②B. ②④C. ②⑥D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时,溴水的质量增加8.4g。则该烷烃的分子为______________,该烯烃的结构简式为____________,烷烃和烯烃的体积比为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是
A. 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B. 需要加热的反应说明它是吸热反应
C. 在稀溶液中:H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kj/mol,若将含0.5 mol H2SO4 的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H可用于光刻工艺中,作抗腐蚀涂层。下面是高聚物H的合成路线:
![]()

Ⅱ.反应③属于加聚反应 Ⅲ.D属于高分子化合物,
请回答下列问题:
(1)反应⑤的条件是_______________;E的分子式为__________________;
(2)C中含有的官能团的名称是________________ ;
(3)芳香烃M与A的实验式相同,经测定M的核磁共振氢谱有5组峰且峰面积比为1:1:2:2:2,则M的结构简式为_____________ ;推测M可能发生的反应类型是___________;(写出一种即可)
(4)反应⑦的化学方程式为___________________________________________________ ;
(5)D和G反应生成H的化学方程式为___________________________________________ ;
(6)G的同分异构体中,与G具有相同官能团的芳香族化合物还有__________种(不考虑立体异构)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com