
【题目】下列说法或表示法正确的是
A. 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B. 需要加热的反应说明它是吸热反应
C. 在稀溶液中:H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kj/mol,若将含0.5 mol H2SO4 的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
科目:高中化学 来源: 题型:
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
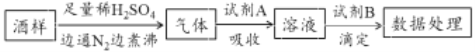
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计正确的是
A.将混有HC1气体的CO2通入装有饱和碳酸钠溶液的洗气瓶,可除去HC1
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D.将SO2通入KMnO4酸性溶液证明SO2具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C2H4O2的有机化合物A具有如下性质:
①A+Na → 迅速产生气泡;
②A+CH3CH2OH ![]() 有香味的物质。
有香味的物质。
(1)根据上述信息,对该化合物可做出的判断是_________(填字母)。
A.一定含有—OH B.一定含有—COOH
C.有机化合物A为乙醇 D.有机化合物A为乙酸
(2)A与金属钠反应的化学方程式为_____________
(3)化合物A和CH3CH2OH反应生成的有香味的物质的结构简式为_______________。
(4)有机化合物B的分子式为C2H4O3,与Na反应迅速产生H2,且1 mol B与足量Na反应放出1 mol H2,则B的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。根据以上条件,回答下列问题:

(1)该反应的化学方程式为________________________
(2)该反应的平衡常数表达式为__________在T℃时,平衡常数的数值为(保留一位小数)___________;
(3)该反应为_________(填“吸热”或“放热”)反应
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_____(填字母)
A.保持其他条件不变,增大压强 B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度 D.保持其他条件不变,降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L CCl4中含CCl4分子数为NA
B. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D. 3.9 g Na2O2 晶体中含有的离子总数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com