
【题目】T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。根据以上条件,回答下列问题:

(1)该反应的化学方程式为________________________
(2)该反应的平衡常数表达式为__________在T℃时,平衡常数的数值为(保留一位小数)___________;
(3)该反应为_________(填“吸热”或“放热”)反应
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有_____(填字母)
A.保持其他条件不变,增大压强 B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度 D.保持其他条件不变,降低温度
【答案】A (g)+ 3C(g)![]() 2B (g)
2B (g)  533.3 吸热 D
533.3 吸热 D
【解析】
(1)由图(Ⅰ)可知,A和C的物质的量浓度减小,B的物质的量浓度增加,则A、C为反应物,B为生成物,由反应的浓度的变化之比等于化学计量数之比判断反应的化学方程式;
(2)结合平衡常数的概念写出表达式,再根据达到平衡时各组分的浓度及平衡常数表达式计算出T℃时该反应化学平衡常数K;
(3)由图(Ⅱ)可知T1>T2,升高温度平衡时B的体积分数增大,说明升高温度平衡向正反应方向移动,据此判断该反应是吸热还是放热反应;
(4)该反应为吸热反应,根据压强、温度、稀有气体对反应A (g)+ 3C(g)![]() 2B (g)的影响进行判断。
2B (g)的影响进行判断。
(1)由图(Ⅰ)可知,A和C的物质的量浓度减小,B的物质的量浓度增加,则A、C为反应物,B为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(C):△c(B)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为:A (g)+ 3C(g)![]() 2B (g);
2B (g);
(2)根据图象可知,达到平衡时各组分的浓度为:c(A)=0.3mol/L,c(C)=0.1mol/L,c(B)=0.4mol/L,T℃时,该反应化学平衡常数K2= =
=![]() ≈533.3;
≈533.3;
(3)由图(Ⅱ)可知T1>T2,升高温度平衡时B的体积分数增大,说明升高温度平衡向正反应方向移动,正反应为吸热反应;
(4)A.保持其他条件不变,增大压强,平衡向正反应方向移动,故A错误;
B 保持容器总体积不变,通入少量稀有气体,各组分的浓度不变,平衡不发生移动,故B错误;
C.该反应为吸热反应,升高温度平衡向正反应方向移动,故C错误;
D.该反应为吸热反应,降低温度平衡向逆反应方向移动,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】F、Cl和Br都是VIIA族元素,关于这三种元素原子说法正确的是
A.原子半径:F>C1>BrB.最外层电子数都相同
C.核外电子层数都相同D.最外层电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是
A. 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B. 需要加热的反应说明它是吸热反应
C. 在稀溶液中:H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kj/mol,若将含0.5 mol H2SO4 的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:运用化学反应原理知识研究如何利用CO、SO2等污染物有非常重要的意义。
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
请写出由CO和H2形成CH3OH的热化学方程式___________________________________________
(2)—定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:
CO(g) +2H2(g)![]() CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:

①下列说法正确的是__________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体平均相对分子质量恒定,反应达到平衡状态
C.若v(CO)=v(CH3OH)时,反应达到平衡状态
D.反应中,催化剂使平衡向正反应方向移动
②该反应的△H________0,p2_______________p1(填“大于”“小于”或“等于”)。
③100℃时,该反应的化学平衡常数K=__________.

II:甲醇是一种燃料,也可以作为燃料电池的原料
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置,则电池正极的电极反应式:______,该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为_______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H可用于光刻工艺中,作抗腐蚀涂层。下面是高聚物H的合成路线:
![]()

Ⅱ.反应③属于加聚反应 Ⅲ.D属于高分子化合物,
请回答下列问题:
(1)反应⑤的条件是_______________;E的分子式为__________________;
(2)C中含有的官能团的名称是________________ ;
(3)芳香烃M与A的实验式相同,经测定M的核磁共振氢谱有5组峰且峰面积比为1:1:2:2:2,则M的结构简式为_____________ ;推测M可能发生的反应类型是___________;(写出一种即可)
(4)反应⑦的化学方程式为___________________________________________________ ;
(5)D和G反应生成H的化学方程式为___________________________________________ ;
(6)G的同分异构体中,与G具有相同官能团的芳香族化合物还有__________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
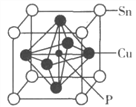
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com