
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
【答案】 浓盐酸 饱和食盐水 稀硝酸 水 e→f(或f→e)→c→b→d 通过观察气泡调节气体的流速 防止水蒸气进入装置Ⅸ中 NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O
【解析】(1)实验室加热制取氯气是用MnO2与浓盐酸加热生成的,所以分液漏斗中装的是浓盐酸,装置Ⅱ是用于吸收氯气中HCl气体,所以内装饱和的食盐水;实验室里NO是用Cu和稀硝酸反应制取的,所以分液漏斗中装的是稀硝酸,装置Ⅱ是用于吸收NO中HNO3蒸气的,因此内装水即可。
(2)已知NOCl沸点为-5.5 ℃,遇水易水解,所以可用冰盐冷却收集液体NOCl,再用装有无水CaCl2的干燥管Ⅶ防止水蒸气进入装置Ⅸ中使NOCl变质,由于NO和Cl2都有毒且污染环境,所以用NaOH吸收尾气,因此①接口顺序为a→e→f(或f→e) →c→b→d,②通过观察洗气瓶中的气泡的快慢,调节NO、Cl2气体的流速,以达到最佳反应比,提高原料的利用率,减少有害气体的排放,③装置Ⅶ中装有的无水CaCl2,是防止水蒸气进入装置Ⅸ中使生成的NOCl变质,④NOCl遇水反应生成HCl和HNO2,再与NaOH反应,所以反应的化学方程式为:NOCl+2NaOH![]() NaCl+NaNO2+H2O。
NaCl+NaNO2+H2O。
(3)由题中叙述可知,反应物为浓硝酸和浓盐酸,生成物为亚硝酰氯和氯气,所以可写出反应的化学方程式为HNO3(浓)+3HCl(浓)![]() NOCl↑+Cl2↑+2H2O。
NOCl↑+Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】(1)金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶角各有一个金原子,各个面的中心有一个金原子。金晶体每个晶胞中含有________个金原子。
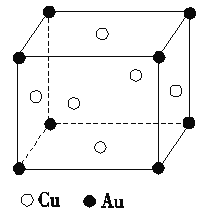
(2)金和铜可以形成多种金属化合物,其中一种的晶体结构如下图所示(为面心立方结构)。该金属化合物的化学式________。
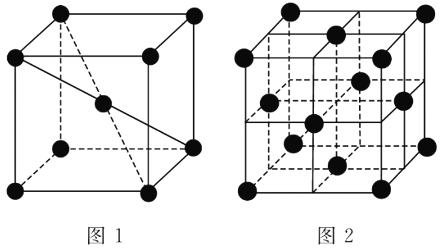
(3)1183 K以下纯铁晶体的基本结构单元如图1所示,1 183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子等距离且最近的铁原子数为________个;在1 183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为________。
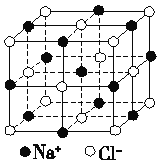
(4)如图为NaCl晶体结构图,图中直线交点处为NaCl晶体中Na+与Cl-所处的位置(不考虑体积的大小)。从晶胞中可以看出Na+周围与它最近时且距离相等的Na+共有________个。
(5)某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心。试分析:
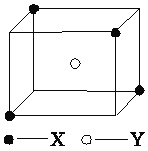
①晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y。
②晶体中在每个X周围与它最接近且距离相等的X共有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中少量杂质所需除杂试剂及方法不正确的是( )
物质(杂质) | 除杂试剂 | 除杂方法 | |
A | 乙醇(水) | CaO | 蒸馏 |
B | 淀粉溶液(NaCl) | ——— | 渗析 |
C | CO2(HCl) | NaOH溶液 | 洗气 |
D | NaCl溶液(I2) | CCl4 | 萃取分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H+、I-、Br2、Na+
B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同。
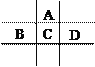
回答下列问题:
(1)A与E形成的化合物的化学式是 __________________。
(2)B的最高价氧化物化学式为____________,C的元素名称为 ___________________ 。
(3)D的单质与水反应的方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的前四周期,回答下列问题:
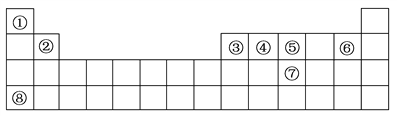
(1)按原子轨道的重叠方式,①与⑤形成的化合物中的共价键属于________(填“σ”或“π”)键。
(2)②、⑤、⑥、⑧四种元素第一电离能由高到低的顺序是________(用元素符号表示)。
(3)元素④形成的单质的晶体类型可以是原子晶体,如________(填写物质名称),也可以是________,如C60。
(4)元素③、⑥形成的化合物与⑦的氢化物均为AB3型,但这两种化合物分子的立体结构明显不同。③、⑥两种元素形成的化合物分子的立体结构为________,⑦的氢化物分子的立体结构为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长期以来一直认为氟的含氧酸不存在,但1971年美国科学家将F2通入细冰沫获得HFO(次氟酸)。
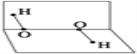
(1)HFO的电子式为________。
(2)HFO与水反应得到物质A(结构如图所示),写出HFO与水反应的化学方程式________________。
(3)分子A中存在________键。A.仅有σ键 B.仅有π键 C.同时含有σ键、π键 D.同时存在极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A.蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台
B.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.丁达尔效应可以鉴别胶体和溶液
D.用规格为10 mL的量筒量取6.20 mL的液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com