
【题目】砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)砷是第四周期VA族元素。下列关于第VA族元素及其化合物的说法不正确的是_______(填序号)。
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的AsH3;
②AsH3与AgNO3溶液反应产生As2O3与另一种固体,该反应的离子方程式为_____________。
(3)砷及其化合物几乎都有毒,通常+3价砷化合物毒性强于+5价砷化合物。海产品中含有微量+5价砷化合物,食用海鲜后不能马上进食水果的原因是________________________________。
(4)砷酸(H3AsO4)可用于制造杀虫剂、药物。As2O3溶于稀硝酸中可得砷酸,此反应的化学方程式为________________________________。
(5)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[Fe(OH)3和FeOOH],吸附沉降砷的化合物。在其它条件一定时,调节水样的pH,得到除砷效率曲线如图所示。
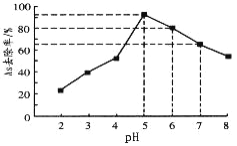
①请解释水样酸性较强时,除砷效率较低的原因是_____________________。
②国家饮用水标准规定水中砷的含量应低于0.05mg·L-1(1mg=1000μg)。某水样中含砷总浓度为100μg·L-1,若控制水样的pH=6,出水后的砷浓度_________________(填“能”或“否”)达到饮用水标准。
【答案】c 2AsH3+12Ag++3H2O=As2O3+12H++12Ag 水果中富含还原性物质(维生素C等),能将+5价的砷化物还原为毒性更大的+3价砷化物 3As2O3+4HNO3+7H2O=6H3AsO4+4NO![]() 酸性较强时,不易生成水合氧化铁,吸附能力下降,除砷效率降低 能
酸性较强时,不易生成水合氧化铁,吸附能力下降,除砷效率降低 能
【解析】
(1)根据元素周期律判断;
(2)②AsH3被氧化,且生成物中有另一种固体,则AgNO3中Ag+被还原为Ag,根据氧化还原配平原则配平即可;
(3)水果中含有大量还原性物质,+5价砷化物具有氧化性,能够与食物中还原性物质发生氧化还原反应生成毒性更大的+3价砷化物;
(4)As2O3中As为+3价。,H3AsO4中As为+5价,即As2O3与稀硝酸反应中As被氧化,稀硝酸被还原,配平即可;
(5)①根据单质铁处理水体砷污染的原理为:单质铁或在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁能吸附沉降砷的化合物,结合水合氧化铁的组成分析;
②根据图可以看出:若控制水样的pH=6,则As的去除率为80%,此时水中剩余的As为20%;污水没有开始处理时,水中As的浓度为100μg/L,水样的pH=6时,水中剩余的As为100μg/L×20%=20μg/L=0.02mg/L,据此判断。
(1)As和N、P位于同一主族,且原子序数As>P>N,根据同主族元素从上到下非金属性逐渐减弱可知,非金属性N>P>As;
a.NH3分子间存在氢键,而PH3分子间不存在氢键,故沸点NH3>PH3,正确;
b.非金属性越强,其最高价氧化物对应的水化物酸性越强,故酸性:HNO3>H3AsO4,正确;
c.As为非金属元素,故其氧化物的水化物不可能都为强碱,错误;
d.同主族元素,从上到下电子层数增加,形成的简单离子电子层数逐渐增加,因此形成的简单离子半径逐渐增加,正确;
(2)②由上述分析可知,该反应的离子反应方程式为:2AsH3+12Ag++3H2O=As2O3+12H++12Ag;
(3)水果中含有大量还原性物质(如维生素C等),+5价砷化物具有氧化性,能够与食物中还原性物质发生氧化还原反应生成毒性更大的+3价砷化物;
(4)由题干信息可知,As2O3反应后化合价升高2,稀硝酸反应生成NO,其中N元素化合价降低3,根据氧化还原反应过程中得失电子守恒,可写出其方程式为:3As2O3+4HNO3+7H2O=6H3AsO4+4NO![]() ;
;
(5)①单质铁处理水体砷污染的原理为:单质铁或在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁能吸附沉降砷的化合物,若水样酸性较强时,单质铁容易被腐蚀,不易生成水合氧化铁;
②由图可以看出:若控制水样的pH=6,则As的去除率为80%,此时水中剩余的As为20%;污水没有开始处理时,水中As的浓度为100μg/L,水样的pH=6时,水中剩余的As为100μg/L×20%=20μg/L=0.02mg/L<0.05mg/L,国家饮用水标准规定水中砷的含量应低于0.05mg/L,故出水后的砷浓度达到饮用水标准。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A____,B___,C___,D____。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是_____。
(3)A与B形成的三原子分子的电子式是___,B与D形成原子个数比为1∶1的化合物的电子式是_____。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是
实验 | 现象 | 结论 | |
A | 将硝酸亚铁样品溶于稀硫酸,滴加KSCN溶液 | 溶液变为红色 | 硝酸亚铁样品已氧化变质 |
B | 向硅酸钠溶液中通入CO2 | 产生白色沉淀 | 非金属性:C>Si |
C | 向盛有FeS固体的烧杯中滴加盐酸,并产生气体通入溴水中 | 溴水褪色 | 还原性:S2->Br->Cl- |
D | 向无色溶液中滴入氯化钡溶液和稀硝酸 | 有白色沉淀产生 | 无色溶液中一定含有SO42-或SO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容器内进行某一反应,M、N的物质的量随反应时间变化的曲线如下图所示,则下列叙述中,正确的是( )

A. 反应的化学方程式一定为2M![]() N
N
B. ![]() 时,逆反应速率一定大于正反应速率
时,逆反应速率一定大于正反应速率
C. ![]() 时,反应达到了化学平衡状态
时,反应达到了化学平衡状态
D. ![]() 时,正反应速率等于逆反应速率
时,正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中的做法不恰当的是( )
A.贮氯罐意外泄漏,应沿逆风方向疏散群众
B.铝制餐具不宜长期存放酸性、碱性或咸的食物
C.氢氧化铝可作胃酸的中和剂
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是



三星烷 四星烷 五星烷
A. 它们之间互为同系物
B. 六星烷的化学式为C18H24
C. 三星烷与丙苯互为同分异构体,四星烷与![]() 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种,而三星烷的二氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
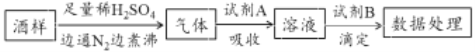
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com