
【题目】由下列实验及现象能推出相应结论的是
实验 | 现象 | 结论 | |
A | 将硝酸亚铁样品溶于稀硫酸,滴加KSCN溶液 | 溶液变为红色 | 硝酸亚铁样品已氧化变质 |
B | 向硅酸钠溶液中通入CO2 | 产生白色沉淀 | 非金属性:C>Si |
C | 向盛有FeS固体的烧杯中滴加盐酸,并产生气体通入溴水中 | 溴水褪色 | 还原性:S2->Br->Cl- |
D | 向无色溶液中滴入氯化钡溶液和稀硝酸 | 有白色沉淀产生 | 无色溶液中一定含有SO42-或SO32- |
A. AB. BC. CD. D
【答案】B
【解析】
A.Fe(NO3)2溶于稀硫酸,溶液中发生离子反应:3Fe2++NO3-+4H+=3Fe3++2H2O+NO![]() ,故无法确定Fe(NO3)2是否已氧化变质,错误;
,故无法确定Fe(NO3)2是否已氧化变质,错误;
B.向Na2SiO3溶液中通入CO2产生白色沉淀,发生反应:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,说明酸性:H2CO3>H2SiO3,碳的最高价氧化物对应水化物H2CO3酸性强于硅的最高价氧化物对应水化物H2SiO3,故能说明非金属性C>Si,正确;
C.FeS与盐酸反应不属于氧化还原反应,故无法判断S2-与Cl-的还原性大小,错误;
D.白色沉淀可能为AgCl、BaSO4,因硝酸具有氧化性,原溶液中可能含有Ag+、SO42-、SO32-、HSO3-,错误。答案选B。


科目:高中化学 来源: 题型:
【题目】碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+。
(1)CH3+ 是反应性很强的正离子,是缺电子的,其电子式是__________________。
(2)CH3+ 中4个原子是共平面的,三个键角相等,键角应是_________(填角度)。
(3)(CH3)2CH+ 在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是_____________。
(4)(CH3)3C+ 去掉H+ 后将生成电中性的有机分子,其结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、E为家庭中常见有机化合物,A与高锰酸钾酸性溶液反应可生成B,D是石油化工发展水平的标志,E是一种常见的高分子材料。根据下面的转化关系回答下列问题:
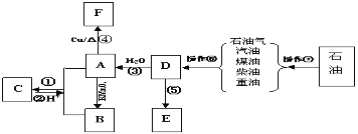
(1)D的结构简式为:_____________。
(2)B中官能团的名称为:______________。
(3)在①~⑤中属于氧化反应的是_________;属于加成反应的是________。(填序号)
(4)写出下列反应方程式:反应①________________________;
反应④_________________________。
(5)用A、B制备物质C时,除去C中含有的杂质选择的试剂及操作分别为___________,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
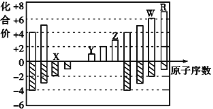
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是
A. 移液时,不慎将液体流到瓶外 B. 容量瓶盛过NaCl溶液,使用前未洗涤
C. 容量瓶中原有少量的蒸馏水 D. 定容时读数仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
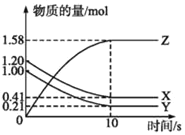
(1)写出该反应的化学方程式___________________
(2)下列叙述中不能说明上述反应达到平衡状态的是___________.
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(3)为使该反应的反应速率减小,可采取的措施是_____.
A 恒压时充入Ne B 适当升高温度
C 缩小容器的体积 D 选择高效催化剂.
II.一定温度下将3mol的A及3molB混合于2L的密闭
容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
求:(1)平衡时B的浓度=______mol/L。
(2)D的平均反应速率υ(D)=______mol/( L.min)。
(3)x=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)砷是第四周期VA族元素。下列关于第VA族元素及其化合物的说法不正确的是_______(填序号)。
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的AsH3;
②AsH3与AgNO3溶液反应产生As2O3与另一种固体,该反应的离子方程式为_____________。
(3)砷及其化合物几乎都有毒,通常+3价砷化合物毒性强于+5价砷化合物。海产品中含有微量+5价砷化合物,食用海鲜后不能马上进食水果的原因是________________________________。
(4)砷酸(H3AsO4)可用于制造杀虫剂、药物。As2O3溶于稀硝酸中可得砷酸,此反应的化学方程式为________________________________。
(5)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[Fe(OH)3和FeOOH],吸附沉降砷的化合物。在其它条件一定时,调节水样的pH,得到除砷效率曲线如图所示。
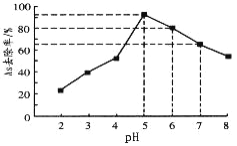
①请解释水样酸性较强时,除砷效率较低的原因是_____________________。
②国家饮用水标准规定水中砷的含量应低于0.05mg·L-1(1mg=1000μg)。某水样中含砷总浓度为100μg·L-1,若控制水样的pH=6,出水后的砷浓度_________________(填“能”或“否”)达到饮用水标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时,溴水的质量增加8.4g。则该烷烃的分子为______________,该烯烃的结构简式为____________,烷烃和烯烃的体积比为:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com