
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时,溴水的质量增加8.4g。则该烷烃的分子为______________,该烯烃的结构简式为____________,烷烃和烯烃的体积比为:________________。
【答案】CH4 CH2=CH2 1:3
【解析】
根据相对密度=![]() 可计算出混合气体的平均相对分子质量,结合常见有机物的相对分子质量判断一定含有甲烷,根据气体的质量、摩尔质量计算混合气体的物质的量,根据混合气通过Br2水时增加的质量为烯烃的质量,可得甲烷的质量,再利用n=
可计算出混合气体的平均相对分子质量,结合常见有机物的相对分子质量判断一定含有甲烷,根据气体的质量、摩尔质量计算混合气体的物质的量,根据混合气通过Br2水时增加的质量为烯烃的质量,可得甲烷的质量,再利用n=![]() 计算出甲烷的物质的量,进而可得烯烃的物质的量,利用n=
计算出甲烷的物质的量,进而可得烯烃的物质的量,利用n=![]() 计算烯烃的摩尔质量,可得其分子式和结构简式,利用n=
计算烯烃的摩尔质量,可得其分子式和结构简式,利用n=![]() 关系得到甲烷与烯烃的体积比。
关系得到甲烷与烯烃的体积比。
(1)混合气体的密度是相同状况下H2密度的12.5倍,所以混合物的平均摩尔质量为12.5×2g/mol=25g/mol,相对分子质量小于25的只有甲烷,所以混合气体中一定有甲烷,混合气体的总的物质的量为:n(总)=![]() =0.4mol,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,则甲烷的质量为10g-8.4g=1.6g,则甲烷的物质的量为n(CH4)=
=0.4mol,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,则甲烷的质量为10g-8.4g=1.6g,则甲烷的物质的量为n(CH4)=![]() =0.1mol,因此烯烃的物质的量为:0.4mol-0.1mol=0.3mol,烯烃的摩尔质量为M(烯)=
=0.1mol,因此烯烃的物质的量为:0.4mol-0.1mol=0.3mol,烯烃的摩尔质量为M(烯)=![]() g/mol,相对分子质量是28,根据烯烃的分子式通式CnH2n=28,可得n=2,所以该烯烃为乙烯CH2=CH2,所以烷烃与烯烃的体积比为:0.1:0.3=1:3。
g/mol,相对分子质量是28,根据烯烃的分子式通式CnH2n=28,可得n=2,所以该烯烃为乙烯CH2=CH2,所以烷烃与烯烃的体积比为:0.1:0.3=1:3。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是
实验 | 现象 | 结论 | |
A | 将硝酸亚铁样品溶于稀硫酸,滴加KSCN溶液 | 溶液变为红色 | 硝酸亚铁样品已氧化变质 |
B | 向硅酸钠溶液中通入CO2 | 产生白色沉淀 | 非金属性:C>Si |
C | 向盛有FeS固体的烧杯中滴加盐酸,并产生气体通入溴水中 | 溴水褪色 | 还原性:S2->Br->Cl- |
D | 向无色溶液中滴入氯化钡溶液和稀硝酸 | 有白色沉淀产生 | 无色溶液中一定含有SO42-或SO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是



三星烷 四星烷 五星烷
A. 它们之间互为同系物
B. 六星烷的化学式为C18H24
C. 三星烷与丙苯互为同分异构体,四星烷与![]() 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种,而三星烷的二氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
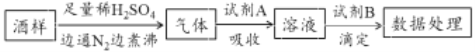
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:

(1)常温下含碳量最高的气态烃是________(填对应字母);
(2)能够发生加成反应的烃有________种;
(3)G的一氯代物有________种;E的二氯代物有_________种;
(4)写出C与溴的四氯化碳溶液反应的化学方程式______________________;
(5)写出F与浓硝酸和浓硫酸反应的化学方程式________________________。反应类型为_______
现有上面A、B、C三种有机化合物:(以下均用结构简式作答)
(6)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____。
(7)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________,生成水最多的是__________。
(8)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计正确的是
A.将混有HC1气体的CO2通入装有饱和碳酸钠溶液的洗气瓶,可除去HC1
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D.将SO2通入KMnO4酸性溶液证明SO2具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,在体积为5 L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为__________,2 s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为________、________。

(2)把0.6 mol X气体与0.6 mol Y气体混合于2 L容器中发生反应:2X(g)+Y(g)=nZ(g)+2W(g),2 min末已生成0.2 mol W,若测得以v(Z)浓度变化表示的v(Z)=0.1 mol/(L·min)。求:
(1)n=_____?
(2)前2 min内,v(X)=_____?
(3)2 min末时Y的浓度_____?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com