
【题目】化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是



三星烷 四星烷 五星烷
A. 它们之间互为同系物
B. 六星烷的化学式为C18H24
C. 三星烷与丙苯互为同分异构体,四星烷与![]() 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种,而三星烷的二氯代物有四种
【答案】BC
【解析】
A、同系物必须是同类物质,并且分子组成上相差整数倍个-CH2-;B、根据三星烷、四星烷的分子式可推知分子通式,再由通式计算六星烷的化学式;C、分子式相同而结构不同的有机物之间互为同分异构体;D、根据对称性的原则,分子中有几种类型的氢原子就存在几种一氯代物;三星烷的二氯代物发生在角上,或正n边形的同一面上,或正n边形的不同面上,或角上、正n边形的面上。
三星烷的分子式为C9H12,四星烷的分子式为C12H16,两个分子之间相差3个C,4个H,二者不互为同系物,A错误;由三星烷、四星烷的分子式可推知分子通式为C3nH4n,六星烷的分子式为C18H24,B正确;丙苯的分子式为C9H12,与三星烷的分子式相同,互为同分异构体,![]() 的分子式为C12H16,与四星烷的分子式相同,互为同分异构体,C正确;“星烷分子”高度对称,它们的一氯代物均只有2种,三星烷的二氯代物发生在角上有2种,发生在正n边形的同一面上有1种,发生在正n边形的不同面上有2种,发生在角上、正n边形的面上有2种,三星烷的二氯代物有7种,D错误。
的分子式为C12H16,与四星烷的分子式相同,互为同分异构体,C正确;“星烷分子”高度对称,它们的一氯代物均只有2种,三星烷的二氯代物发生在角上有2种,发生在正n边形的同一面上有1种,发生在正n边形的不同面上有2种,发生在角上、正n边形的面上有2种,三星烷的二氯代物有7种,D错误。
故选BC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
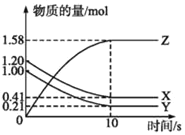
(1)写出该反应的化学方程式___________________
(2)下列叙述中不能说明上述反应达到平衡状态的是___________.
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(3)为使该反应的反应速率减小,可采取的措施是_____.
A 恒压时充入Ne B 适当升高温度
C 缩小容器的体积 D 选择高效催化剂.
II.一定温度下将3mol的A及3molB混合于2L的密闭
容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
求:(1)平衡时B的浓度=______mol/L。
(2)D的平均反应速率υ(D)=______mol/( L.min)。
(3)x=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)砷是第四周期VA族元素。下列关于第VA族元素及其化合物的说法不正确的是_______(填序号)。
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的AsH3;
②AsH3与AgNO3溶液反应产生As2O3与另一种固体,该反应的离子方程式为_____________。
(3)砷及其化合物几乎都有毒,通常+3价砷化合物毒性强于+5价砷化合物。海产品中含有微量+5价砷化合物,食用海鲜后不能马上进食水果的原因是________________________________。
(4)砷酸(H3AsO4)可用于制造杀虫剂、药物。As2O3溶于稀硝酸中可得砷酸,此反应的化学方程式为________________________________。
(5)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[Fe(OH)3和FeOOH],吸附沉降砷的化合物。在其它条件一定时,调节水样的pH,得到除砷效率曲线如图所示。
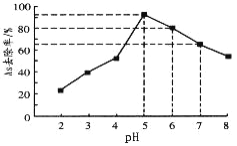
①请解释水样酸性较强时,除砷效率较低的原因是_____________________。
②国家饮用水标准规定水中砷的含量应低于0.05mg·L-1(1mg=1000μg)。某水样中含砷总浓度为100μg·L-1,若控制水样的pH=6,出水后的砷浓度_________________(填“能”或“否”)达到饮用水标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F、Cl和Br都是VIIA族元素,关于这三种元素原子说法正确的是
A.原子半径:F>C1>BrB.最外层电子数都相同
C.核外电子层数都相同D.最外层电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法不正确的是
A. 100mL l mol·L-1KClO溶液中,阴离子的数目大于0.1NA
B. 14g乙烯和丙烯混合气体中含有C—H共价键的数目为2NA
C. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
D. 含0.4molHNO3的浓硝酸与足量铜反应,转移的电子数等于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时,溴水的质量增加8.4g。则该烷烃的分子为______________,该烯烃的结构简式为____________,烷烃和烯烃的体积比为:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com