
【题目】下列生活中的做法不恰当的是( )
A.贮氯罐意外泄漏,应沿逆风方向疏散群众
B.铝制餐具不宜长期存放酸性、碱性或咸的食物
C.氢氧化铝可作胃酸的中和剂
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:______________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是__________________________;乙的作用是__________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。集气瓶中收集到的气体的主要成分是__________________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入________________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是
A. 移液时,不慎将液体流到瓶外 B. 容量瓶盛过NaCl溶液,使用前未洗涤
C. 容量瓶中原有少量的蒸馏水 D. 定容时读数仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
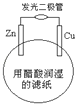
A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)砷是第四周期VA族元素。下列关于第VA族元素及其化合物的说法不正确的是_______(填序号)。
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的AsH3;
②AsH3与AgNO3溶液反应产生As2O3与另一种固体,该反应的离子方程式为_____________。
(3)砷及其化合物几乎都有毒,通常+3价砷化合物毒性强于+5价砷化合物。海产品中含有微量+5价砷化合物,食用海鲜后不能马上进食水果的原因是________________________________。
(4)砷酸(H3AsO4)可用于制造杀虫剂、药物。As2O3溶于稀硝酸中可得砷酸,此反应的化学方程式为________________________________。
(5)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[Fe(OH)3和FeOOH],吸附沉降砷的化合物。在其它条件一定时,调节水样的pH,得到除砷效率曲线如图所示。
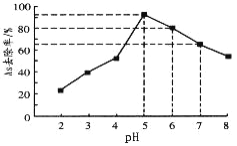
①请解释水样酸性较强时,除砷效率较低的原因是_____________________。
②国家饮用水标准规定水中砷的含量应低于0.05mg·L-1(1mg=1000μg)。某水样中含砷总浓度为100μg·L-1,若控制水样的pH=6,出水后的砷浓度_________________(填“能”或“否”)达到饮用水标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F、Cl和Br都是VIIA族元素,关于这三种元素原子说法正确的是
A.原子半径:F>C1>BrB.最外层电子数都相同
C.核外电子层数都相同D.最外层电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )

①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔
A. ①②B. ②④C. ②⑥D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:运用化学反应原理知识研究如何利用CO、SO2等污染物有非常重要的意义。
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
请写出由CO和H2形成CH3OH的热化学方程式___________________________________________
(2)—定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:
CO(g) +2H2(g)![]() CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:

①下列说法正确的是__________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体平均相对分子质量恒定,反应达到平衡状态
C.若v(CO)=v(CH3OH)时,反应达到平衡状态
D.反应中,催化剂使平衡向正反应方向移动
②该反应的△H________0,p2_______________p1(填“大于”“小于”或“等于”)。
③100℃时,该反应的化学平衡常数K=__________.

II:甲醇是一种燃料,也可以作为燃料电池的原料
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置,则电池正极的电极反应式:______,该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为_______________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com