
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
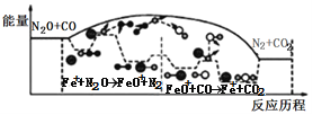
A.反应总过程是放热的
B.Fe+作为催化剂改变了反应途径,提高了反应速率
C.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应
D.若反应在恒容密闭容器中进行,温度越高,反应速率一定越快
【答案】D
【解析】
由图可知,N2O与CO的反应是放热反应,它们在Fe+做催化剂作用下发生Fe++N2O→FeO++N2、FeO++CO→Fe++CO2反应,都是总能量降低,都是放热反应。
A.由图可知,N2O与CO反应前后总能量降低,是放热反应,A正确;
B.由Fe++N2O→FeO++N2、FeO++CO→Fe++CO2可知,Fe+先消耗后生成,总量保持不变,起催化剂作用,B正确;
C.由图可知,Fe++N2O→FeO++N2、FeO++CO→Fe++CO2反应,都是总能量降低,都是放热反应,C正确;
D.该反应使用了Fe+做催化剂,催化剂的活性与温度有关,只有在适当的温度范围内才能发挥催化剂的催化活性,所以温度越高,反应速率不一定越快,D错误;
答案选D。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:
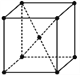
(1) 每一个晶胞中分摊到________个钨原子。
(2) 计算晶胞的边长a_____。
(3) 计算钨的原子半径r_____ (提示:只有体对角线上的各个球才是彼此接触的)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH值一样的定义来规定其酸碱度:pD=-lgc(D+),下列有关pD的叙述正确的是
①中性D2O的PD>7
②在1LD2O中,溶解0.01molNaOD,其pD值为12
③1L0.01mol/L的DCl的重水溶液,pD=2
④在100mL0.25mol/LDCl的重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,反应后溶液的pD=2
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制 500 mL 浓度为 0.2 mol·L-1 稀硫酸,需用量筒量取密度为 1.84 g·cm-3 溶质质量分数为98%的浓 H2SO4 __________mL,然后再与适量水混合稀释,待________ 后,再转移 到____中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_________ (填“大于”“小于”或“等于”)0.2 mol·L-1。
(3)在实验(1)中,转移溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度 (填 “大于”“小于”或“等于”)______________0.2 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
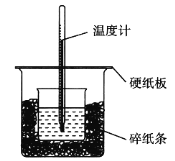
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。

回答下列问题:
(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有_____________;
(2)固体A的主要成分是________;
(3)进行步骤Ⅱ时,为了达到分离要求,加入的NaOH应该_____(填少量或过量)。
(4)进行步骤Ⅲ时,一般通入过量CO2,其反应的离子方程式是________;
(5)溶液X和盐酸反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2和浓盐酸制氯气的反应为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g MnO2被还原,那么:
MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g MnO2被还原,那么:
(1)产生的Cl2在标准状况下的体积为__________;
(2)转移电子的物质的量为_______________;
(3)纺织工业中常用氯气作漂白剂,漂白布匹后,过量的氯需要除去,通常可用Na2SO3作“脱氯剂”,脱氯后的产物为Na2SO4,氯变为-1价。若把本题中产生的Cl2完全转化,需要Na2SO3的质量为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
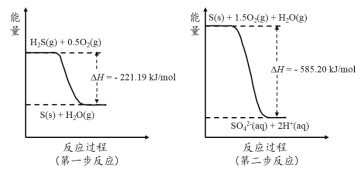
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
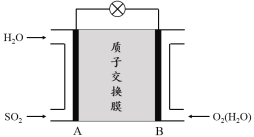
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
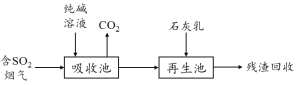
用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com