
【题目】25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH值一样的定义来规定其酸碱度:pD=-lgc(D+),下列有关pD的叙述正确的是
①中性D2O的PD>7
②在1LD2O中,溶解0.01molNaOD,其pD值为12
③1L0.01mol/L的DCl的重水溶液,pD=2
④在100mL0.25mol/LDCl的重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,反应后溶液的pD=2
A. ①②B. ③④C. ①③D. ②④
【答案】C
【解析】
①25℃时,重水(D2O)的离子积为1.6×10-15,中性纯水中,C(D+)=C(HD-)=![]() mol/L=4×10-8mol/L,PD=-lg[D+]=8-lg4>7,故①正确;
mol/L=4×10-8mol/L,PD=-lg[D+]=8-lg4>7,故①正确;
②在1LD2O中,溶解0.01molNaOD,NaOD的物质的量浓度小于0.01mol/L,所以C(HD-)<0.01mol/L,C(D+)>1.6×10-13,则PD值>12,故②错误;
③1L0.01mol/L的DCl的重水溶液,C(D+)=0.01mol/L,PD=2,故正确;
④在100mL0.25mol/LDCl的重水溶液中,n(DCl)=0.25mol/L×0.1L=0.025mol,50mL0.2mol/LNaOD的重水溶液中,C(NaOD)=0.2mol/L×0.05L=0.01mol<n(DCl),则酸过量,混合溶液中C(DCl)=![]() =0.1mol/L,则C(D+)=0.1mol/L,PD=1,故④错误;
=0.1mol/L,则C(D+)=0.1mol/L,PD=1,故④错误;
答案选C。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】某研究小组以苯乙烯和乙烯为主要原料,设计出医药中间体G的合成路线如图:
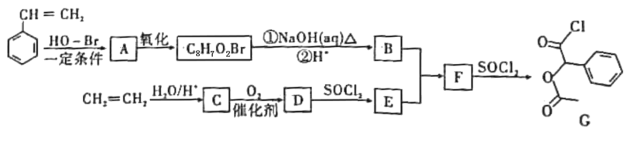
已知RCOOH![]() RCOCl
RCOCl![]() RCOOR’。
RCOOR’。
(1)B中含氧官能团的名称为___;D的结构简式为___。
(2)乙烯的某种同系物的化学名称为“甲基丙烯”,则甲基丙烯的结构简式为___。
(3)B能通过分子间脱水生成有机物X,X可用于香料,其结构中含有三个六元环状结构,则B转化为X的化学方程式:___。
(4)M是G的同分异构体,符合下列结构和性质的芳香族化合物M共有___种(不考虑立体异构)。
①1molM与银氨溶液反应最多能得4molAg;
②苯环上有四个取代基,其相对位置为![]() ;
;
③核磁共振氢谱为5组峰,且峰面积为2:2:2:2:1;
④M能发生消去反应。
写出M发生消去反应的化学方程式:___(一例即可)。
(5)设计出以甲苯为原料制备B的合成路线(无机试剂任选,已知:RCHO![]()
![]() ,RCN
,RCN![]() RCOOH)___。
RCOOH)___。
合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请你回答下列问题:
(1)请按要求任意写一个相应物质:(填化学式)含有非极性键的离子化合物________,既含有非极性键又含极性键的非极性分子________,既含有非极性键又含极性键的极性分子________,全部由非金属元素组成的离子化合物________,由金属元素和非金属元素组成的共价化合物________。
(2)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ的分子结构如图所示。


苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图所示的结构,则其在水中的溶解度会________(填“增大”或“减小”),原因是_____________________________________。
(3)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
(4)下图中A,B,C,D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是________;表示ⅣA族元素氢化物沸点的曲线是________;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是_____________________________;A,B,C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别调节浓度均为0.1 mol·L-1 HA溶液、HB的溶液的pH,所得溶液中酸分子的百分含量ω%(如HA的百分含量为![]() ×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
×100%)与pH的变化关系如图所示。已知调节pH时不影响溶液总体积。下列说法不正确的是
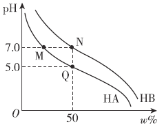
A.常温下,Ka(HA)=1.0×10-5B.M、N两点对应离子浓度:c(A-)=c(B-)
C.将M、N两点溶液等体积混合,溶液呈中性D.水的电离程度:M=N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是药物的中间体,它的一种合成路线如下。
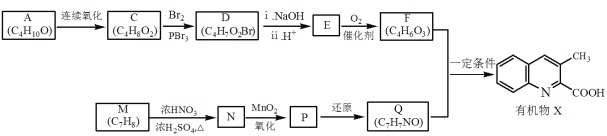
已知:RNH2+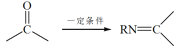 +H2O
+H2O
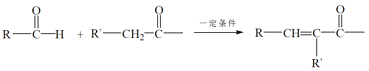
(1)A无支链,A中含有的官能团名称是___。
(2)A连续氧化的步骤如下:
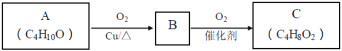
A转化为B的化学方程式是___。
(3)M为芳香化合物,其结构简式是___。
(4)M→N的化学方程式是___,反应类型是___。
(5)下列说法不正确的是___。
a.1molD与NaOH溶液反应时,最多消耗2molNaOH
b.E在一定条件下可生成高分子化合物 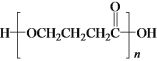
c.F能发生酯化反应和消去反应
(6)Q的结构简式是___。
(7)以乙烯为起始原料,选用必要的无机试剂合成A,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2 II
CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
(备注)Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=___;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生活中 Na2CO3和NaHCO3都可作食用碱。下列对其性质的描述用化学方程式或离子方程式表示正确的是
A.NaHCO3可作发酵粉:2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
B.饱和Na2CO3溶液中通入CO2: CO32- +CO2+ H2O → HCO3-
C.Na2CO3溶液呈碱性:CO32-+ 2H2O → H2CO3+ 2OH-
D.饱和Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32- + 2H+ →CO2↑ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
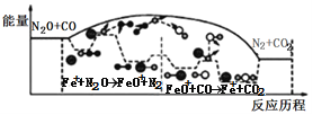
A.反应总过程是放热的
B.Fe+作为催化剂改变了反应途径,提高了反应速率
C.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应
D.若反应在恒容密闭容器中进行,温度越高,反应速率一定越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.9 g镁铝合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的体积是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com