
②CO(g)+![]() O2(g)
O2(g) ![]() CO2(g) ΔH2=-282.57 kJ·mol-1
CO2(g) ΔH2=-282.57 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3,则ΔH3等于( )
CO2(g) ΔH3,则ΔH3等于( )
A.+172.22 kJ·mol-1 B.-172.22 kJ·mol-1
C.+392.92 kJ·mol-1 D.-392.92 kJ·mol-1
科目:高中化学 来源: 题型:阅读理解
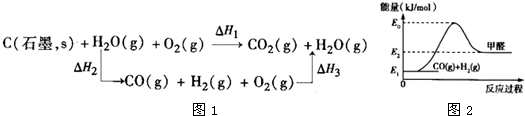
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三上学期期末考试化学试卷(解析版) 题型:填空题
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如
图所示:

①上述生产过程的能量转化方式是____________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:
①2C(s)+O 2(g)= 2CO (g) △H =-221.0 kJ/mol
②C(s)+O 2(g)=CO2 (g) △H =-393.51kJ/mol
计算反应C(s)+CO2 (g)=2CO (g)的反应热△H为
查看答案和解析>>
科目:高中化学 来源:0116 月考题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com