
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于第四周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,C位于s区且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且位于同一族原子序数相差为2。
(1)六种元素中第一电离能最小的是__________(填元素符号,下同),电负性最大的是__________。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式__________,1molAB+中含有π键的数目为____________,黄血盐晶体中各种微粒间的作用力不涉及__________(填序号)。
a.离子键b.共价键c.配位键
d.金属键e.氢键f.分子间的作用力
(3)E2+的价层电子排布图为____________,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③![]() 、④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为____________,它与氢气的加成产物熔、沸点比CH4的熔、沸点高,其主要原因是______________________________________(须指明加成产物是何物质)。
、④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为____________,它与氢气的加成产物熔、沸点比CH4的熔、沸点高,其主要原因是______________________________________(须指明加成产物是何物质)。
【答案】 K N K4[Fe(CN)6] 2NA def ![]() ①③④ 平面三角形 加成产物为CH3OH,分子之间可以形成氢键,导致物质熔沸点反常的高
①③④ 平面三角形 加成产物为CH3OH,分子之间可以形成氢键,导致物质熔沸点反常的高
【解析】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni。
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,故答案为:K;N;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1molCN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,故答案为:K4[Fe(CN)6];2NA;def;
(3)Ni2+的价层电子排布式为3d8,故价电子排布图为![]() ;①CH2=CH2、③
;①CH2=CH2、③ 、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,故答案为:
、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,故答案为:![]() ;①③④;平面三角;加成产物CH3OH分子之间能形成氢键,导致物质熔沸点反常的高。
;①③④;平面三角;加成产物CH3OH分子之间能形成氢键,导致物质熔沸点反常的高。


科目:高中化学 来源: 题型:
【题目】X2﹣与Y+离子都与Ar原子具有相同的核外电子排布,则下列叙述中正确的是( )
A.原子序数X>Y
B.离子半径X>Y
C.X和Y一定在同一周期
D.X是第IIA族元素,Y是第VIIA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 原电池中发生的反应达到平衡时,该电池无电流产生
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJmol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为__________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1。
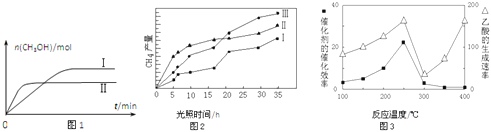
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ__________KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为__________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为__________(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水中逐滴加入0.1000mol/L的HC1溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是
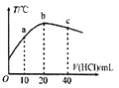
A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,该氨水的pH约为12
B. 若a点溶液呈碱性,则a点溶液中:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b点溶液pH=7,c点溶液pH<7
D. b点溶液中: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是( )

A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中不正确的是
A. 量取100 mL,该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有29.25 g NaCl
C. 配制100 mL该溶液,用托盘天平称5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有关下列有机物的说法中错误的是
A. 石油经分馏后再通过裂化和裂解得到汽油
B. 植物油通过氢化加成可以变成脂肪
C. 用灼烧的方法可以区别蚕丝和合成纤维
D. 在做淀粉的水解实验时,用碘水检验淀粉是否完全水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com