
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水中逐滴加入0.1000mol/L的HC1溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是
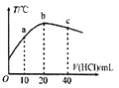
A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,该氨水的pH约为12
B. 若a点溶液呈碱性,则a点溶液中:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b点溶液pH=7,c点溶液pH<7
D. b点溶液中: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
【答案】B
【解析】A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,NH3·H2O![]() NH4++OH-,则c(OH-)=0.1000mol/L×1.33%=0.00133 mol/L,则c(H+)=
NH4++OH-,则c(OH-)=0.1000mol/L×1.33%=0.00133 mol/L,则c(H+)=![]() =
=![]() ×10-11,该氨水的pH约为11,故A错误;B.a点溶液中溶质为等浓度的氨水和氯化铵,溶液显碱性,氨水的电离程度大于氯化铵的水解程度,所以a点有:c(NH4+)> c(Cl-)>c(NH3H2O),故B正确;C. b点溶液为氯化铵溶液,水解,溶液显酸性,pH<7,故C错误;D.b点盐酸与氨水恰好反应生成氯化铵,氯化铵的浓度为0.0500molL-1,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:c(Cl-)= c(NH4+)+ c(NH3H2O),则0.0500molL-1+c(OH-)=c(NH4+)+c(H+)= c(Cl-)- c(NH3H2O)+c(H+),故D错误;
×10-11,该氨水的pH约为11,故A错误;B.a点溶液中溶质为等浓度的氨水和氯化铵,溶液显碱性,氨水的电离程度大于氯化铵的水解程度,所以a点有:c(NH4+)> c(Cl-)>c(NH3H2O),故B正确;C. b点溶液为氯化铵溶液,水解,溶液显酸性,pH<7,故C错误;D.b点盐酸与氨水恰好反应生成氯化铵,氯化铵的浓度为0.0500molL-1,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:c(Cl-)= c(NH4+)+ c(NH3H2O),则0.0500molL-1+c(OH-)=c(NH4+)+c(H+)= c(Cl-)- c(NH3H2O)+c(H+),故D错误;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于第四周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,C位于s区且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且位于同一族原子序数相差为2。
(1)六种元素中第一电离能最小的是__________(填元素符号,下同),电负性最大的是__________。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式__________,1molAB+中含有π键的数目为____________,黄血盐晶体中各种微粒间的作用力不涉及__________(填序号)。
a.离子键b.共价键c.配位键
d.金属键e.氢键f.分子间的作用力
(3)E2+的价层电子排布图为____________,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③![]() 、④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为____________,它与氢气的加成产物熔、沸点比CH4的熔、沸点高,其主要原因是______________________________________(须指明加成产物是何物质)。
、④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为____________,它与氢气的加成产物熔、沸点比CH4的熔、沸点高,其主要原因是______________________________________(须指明加成产物是何物质)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA
B. 3.6g重水中含有的中子数为2 NA
C. 常温下,1L1mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
D. 一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用基本公式进行计算:
(1)标准状况下,①4g氢气、 ②33.6L甲烷(CH4)、 ③6.02×1024个水分子、④1mol NH3中,
分子数由大到小的顺序为 ____________________(填序号,下同),含氢原子数最多的是_________,体积最大的是____________。
(2)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(混合后体积变化忽略不计),
所得溶液中Cl-的物质的量浓度是_____________________。
(3)已知224L标准状况下的HCl气体完全溶于1L水(密度为1g/cm3)得到密度为1.1g/cm3的盐酸,此盐酸的物质的量浓度为:__________________ (保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com