
【题目】关于烷烃的叙述正确的是
A.C5H12有3种同分异构体B.烷烃的通式为CnH2n
C.C6H14在常温下为气体D.烷烃都能溶于水
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.氯化钠可用于制备纯碱
B.食品袋中常放有生石灰,能起到抗氧化剂的作用
C.大力发展新能源汽车能减少酸雨危害
D.石油裂化、煤的干馏、玉米制乙醇、蛋白质变性都属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水中逐滴加入0.1000mol/L的HC1溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是
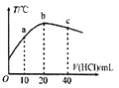
A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,该氨水的pH约为12
B. 若a点溶液呈碱性,则a点溶液中:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b点溶液pH=7,c点溶液pH<7
D. b点溶液中: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%) 主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制各纯度较高的氢氧化镍,工艺流程如下: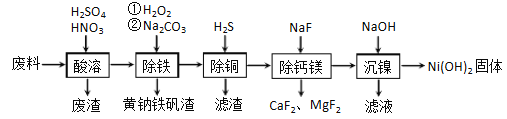
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成.写出金属镍溶解的离子方程式________________________________________。
(2)“除铁”时H2O2的作用是____________,为了证明添加的H2O2已足量,应选择的试剂是_____________(用化学式表示)溶液。黄钠铁矾[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,此步骤加入碳酸钠的目的是_________________________。
(3)“除铜”时,反应的离子方程式为_________________________,若用Na2S代替H2S除铜,优点是_________________________。
(4)已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程中Ni(OH)2 生成时,调节pH 约为________Ni2+刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,认为该离子沉淀完全: lg2=0.30)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中不正确的是
A. 量取100 mL,该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有29.25 g NaCl
C. 配制100 mL该溶液,用托盘天平称5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的叙述正确的是
A.苯在常温下为液体,密度比水大
B.苯环是由单、双键交替形成的平面六元环结构
C.1 mol苯最多与3 mol H2发生加成反应
D.苯在FeBr3催化作用下能与Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙酸和乙醇的叙述正确的是
A.都能使石蕊溶液变红
B.分子中原子之间只存在单键
C.都能与钠反应并生成H2
D.都能与NaHCO3反应并生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关键能数据如表
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2 kJ·mol-1,则表中x的值为 ( )
A.460B.920
C.1165.2D.423.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X.Y、Z、W四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
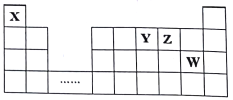
A. 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y)
B. X、Y、Z既能形成离子化合物,又能形成共价化合物
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D. H2Z的熔点比HW高,是因为它们的晶体类型不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com