
【题目】一种磁性材料的磨削废料(含镍质量分数约21%) 主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制各纯度较高的氢氧化镍,工艺流程如下: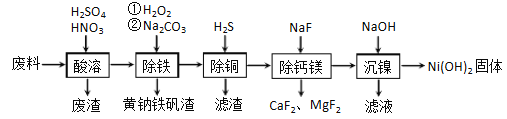
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成.写出金属镍溶解的离子方程式________________________________________。
(2)“除铁”时H2O2的作用是____________,为了证明添加的H2O2已足量,应选择的试剂是_____________(用化学式表示)溶液。黄钠铁矾[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,此步骤加入碳酸钠的目的是_________________________。
(3)“除铜”时,反应的离子方程式为_________________________,若用Na2S代替H2S除铜,优点是_________________________。
(4)已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程中Ni(OH)2 生成时,调节pH 约为________Ni2+刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,认为该离子沉淀完全: lg2=0.30)。
【答案】 5Ni+12H++2NO3-=5Ni2++N2↑+6H2O 将亚铁离子氧化为铁离子 K3[Fe(CN)6] 提高溶液的碱性,使黄钠铁矾形成析出 H2S+Cu2+=CuS↓+2H+ 无易挥发的有毒气体硫化氢污染环境 过量的F离子生成氢氟酸会腐蚀陶瓷容器 9.1或9.2(或9.1~9.2之间)
【解析】(1)镍在非氧化性酸中不溶,在氧化性酸(如硝酸)能够把金属镍溶解,反应的离子方程式为:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O;正确答案:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O。
(2)利用双氧水的氧化性,将亚铁离子氧化为铁离子;H2O2已足量时,溶液中没有亚铁离子了,加入K3[Fe(CN)6]溶液,没有蓝色沉淀,证明H2O2过量;碳酸钠溶液水解显碱性,加入碳酸钠的目的提高溶液的碱性,使黄钠铁矾形成析出;正确答案:将亚铁离子氧化为铁离子 ; K3[Fe(CN)6] ; 提高溶液的碱性,使黄钠铁矾形成析出。
(3)“除铜”时,铜离子与硫化氢反应生成硫化铜沉淀,反应的离子方程式为H2S+Cu2+=CuS↓+2H+;若用Na2S代替H2S除铜,优点是无易挥发的有毒气体硫化氢污染环境;正确答案:H2S+Cu2+=CuS↓+2H+;无易挥发的有毒气体硫化氢污染环境。
(4)NaF溶液水解产生少量氢氟酸,当NaF溶液用量太大时,氢氟酸的量增多,氢氟酸能够与陶瓷容器中二氧化硅反应而使陶瓷容器被腐蚀,正确答案:过量的F-离子生成氢氟酸会腐蚀陶瓷容器。
(5)Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=2.0×10-15,当c(Ni2+)=1×10-5mol·L-1,c2(OH-)=2×10-10,c(OH-)=1.4×10-5,c(H+)=1/1.4×10-9, pH=9.1,正确答案:9.1或9.2(或9.1~9.2之间)。


科目:高中化学 来源: 题型:
【题目】已知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )


A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+) > c(ClO-) > c(CH3COO-)> c(OH-) > c(H+)
B. 向NaClO溶液中通少量CO2的离子方程式为:2ClO- + CO2 + H2O = 2HClO + CO32-
C. 图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点对应酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA
B. 3.6g重水中含有的中子数为2 NA
C. 常温下,1L1mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
D. 一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:
(已知碳酸氢铵受热分解后无固体剩余)

请根据操作流程回答下列问题:
(1)操作①在加热时应选择用_____________来盛装混合物(填仪器名称)。
(2)操作②发生的化学反应方程式为:___________________________________________;
判断SO42-已沉淀完全的方法是______________________________________________。
(3)操作③的目的是___________________________________。
(4)操作④和操作⑥的分离提纯方法的名称分别是____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验。化学反应如下:KMnO4+H2C2O4+H2SO4—K2SO4+MnSO4+CO2↑+H2O(未配平)实验主要步骤如下:
Ⅰ、称取2.8g草酸晶体(H2C2O4·2H2O)配成100mL草酸溶液
Ⅱ、取25.00ml草酸溶液于锥形瓶中,加入适量稀硫酸,用0.1000mol·L-1酸性高锰酸钾溶液滴定,消耗KMnO4溶液20.00mL。

根据上述实验步骤请回答下列问题:
(1)高锰酸钾溶液应盛装于__________ (填“甲”或“乙”)滴定管。
(2)滴定到达终点的判断标志是_________________________________。
(3)下列造成草酸晶体质量分数偏高的是__________。
A.滴定终点读数时俯视 B.滴定前有气泡,滴定后气泡消失
C.润洗锥形瓶 D.流定过程中加入少量蒸馏水冲洗瓶壁
(4)完成酸性高锰酸钾溶液和H2C2O4(已知草酸为弱酸)溶液反应的离子方程式:__________________。
(5)该草酸晶体的质量分数为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com