
【题目】某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验。化学反应如下:KMnO4+H2C2O4+H2SO4—K2SO4+MnSO4+CO2↑+H2O(未配平)实验主要步骤如下:
Ⅰ、称取2.8g草酸晶体(H2C2O4·2H2O)配成100mL草酸溶液
Ⅱ、取25.00ml草酸溶液于锥形瓶中,加入适量稀硫酸,用0.1000mol·L-1酸性高锰酸钾溶液滴定,消耗KMnO4溶液20.00mL。

根据上述实验步骤请回答下列问题:
(1)高锰酸钾溶液应盛装于__________ (填“甲”或“乙”)滴定管。
(2)滴定到达终点的判断标志是_________________________________。
(3)下列造成草酸晶体质量分数偏高的是__________。
A.滴定终点读数时俯视 B.滴定前有气泡,滴定后气泡消失
C.润洗锥形瓶 D.流定过程中加入少量蒸馏水冲洗瓶壁
(4)完成酸性高锰酸钾溶液和H2C2O4(已知草酸为弱酸)溶液反应的离子方程式:__________________。
(5)该草酸晶体的质量分数为_____________________________。
【答案】 甲 加入最后一滴KMnO4溶液,溶液由无色变为紫红色,且30s内不褪色 BC 5H2C2O4+ 2MnO4-+ 6H+ = 10CO2↑+ 2Mn2++ 8H2O 90%
【解析】(1)高锰酸钾溶液具有强氧化性,腐蚀橡胶,碱式滴定管下端有一段橡胶管,只能选用酸式滴定管,正确答案:甲;
(2)高锰酸钾溶液氧化草酸,溶液褪色,当加到最后一点高锰酸钾溶液时,反应液的颜色不再发生变化,且30秒内颜色保持不变,达滴定终点;正确答案:加入最后一滴KMnO4溶液,溶液由无色变为紫红色,且30s内不褪色;
(3)A.滴定终点读数时俯视,消耗高锰酸钾溶液的体积减少,所测结果偏低;A错误;B.滴定前有气泡,滴定后气泡消失,读数偏大,相当于消耗高锰酸钾溶液的体积增多,所 测结果偏高;B正确;C.润洗锥形瓶,造成草酸的量增大,消耗高锰酸钾溶液的体积增大,测定结果偏高;C 正确;D.滴定过程中加入少量蒸馏水冲洗瓶壁,溶质的量保持不变,测定结果无影响;D错误;正确选项:BC;
(4)酸性高锰酸钾被还原为锰离子,H2C2O4被氧化为二氧化碳;正确答案:5H2C2O4+ 2MnO4-+ 6H+= 10CO2↑+ 2Mn2++ 8H2O;
(5)根据反应关系式:5H2C2O4----2MnO4-,设消耗草酸的量为xmol, x=2.5×0.1000×20.00×10-3=5×10-3mol,由题意可知:100mL草酸溶液中含有草酸的量为5×10-3mol×100/25=2×10-2 mol; 草酸晶体的质量为2×10-2×126=2.52g,该草酸晶体的质量分数=2.52÷2.8×100%=90%;正确答案:90%;


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%) 主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制各纯度较高的氢氧化镍,工艺流程如下: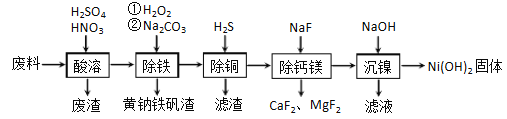
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成.写出金属镍溶解的离子方程式________________________________________。
(2)“除铁”时H2O2的作用是____________,为了证明添加的H2O2已足量,应选择的试剂是_____________(用化学式表示)溶液。黄钠铁矾[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,此步骤加入碳酸钠的目的是_________________________。
(3)“除铜”时,反应的离子方程式为_________________________,若用Na2S代替H2S除铜,优点是_________________________。
(4)已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程中Ni(OH)2 生成时,调节pH 约为________Ni2+刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,认为该离子沉淀完全: lg2=0.30)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关键能数据如表
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2 kJ·mol-1,则表中x的值为 ( )
A.460B.920
C.1165.2D.423.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)在2L定容密闭容器中通入1molN2(g)和3molH2(g),发生反应:
3H2(g)+N2(g)![]() 2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
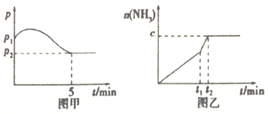
①若图中c=1.6mol,则改变的条件是__________(填字母,下同);
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是__________(填字母);此时该反应的平衡常数__________(填“增大”、“减小”、“不变”)。
(2)如图甲,平衡时氢气的转化率为____________。
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
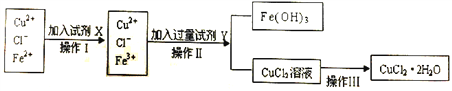
(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是__________。
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的__________。
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
物质 | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=__________。
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是__________(填化学式);操作Ⅲ后由CuCl2·2H2O晶体得到纯净无水CuCl2的合理操作是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的离子方程式正确的是
A. 用醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 酸性KI淀粉溶液久置后变蓝:4I-+O2+4H+=2I2+2H2O
D. Na2S溶液使酚酞试液变红:S2-+2H2O![]() 2OH-+H2S
2OH-+H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X.Y、Z、W四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
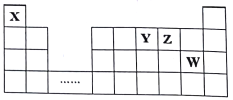
A. 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y)
B. X、Y、Z既能形成离子化合物,又能形成共价化合物
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D. H2Z的熔点比HW高,是因为它们的晶体类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是人类最理想的能源。已知在25℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2=2H2O ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com