
����Ŀ����1����2L�����ܱ�������ͨ��1molN2(g)��3molH2(g),������Ӧ��
3H2(g)+N2(g)![]() 2NH3(g)��H<0,���ѹǿһʱ��ͼ����ͼ�ף����p2=0.6p1����ʱ�¶�����ʼ�¶���ͬ���ڴﵽƽ��ǰijһʱ��(t1)�����ı�һ���������õ�����ͼ��
2NH3(g)��H<0,���ѹǿһʱ��ͼ����ͼ�ף����p2=0.6p1����ʱ�¶�����ʼ�¶���ͬ���ڴﵽƽ��ǰijһʱ��(t1)�����ı�һ���������õ�����ͼ��
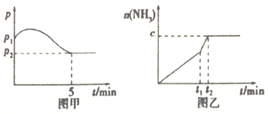
����ͼ��c=1.6mol,��ı��������__________(����ĸ����ͬ);
A������ B������ C����ѹ D����ѹ E���Ӵ���
����ͼ��c<1.6mol,��ı��������__________(����ĸ);��ʱ�÷�Ӧ��ƽ�ⳣ��__________(���������С���������䡱)��
��2����ͼ�ף�ƽ��ʱ������ת����Ϊ____________��
���Ƶ�CuCl2��2H2O�����г�����Fe3+��Fe2+���ʣ�Ϊ�Ƶô������Ȼ�ͭ���壬���Ƚ����Ƴ�ˮ��Һ���ٰ���ͼ��ʾ�IJ�����������ᴿ��
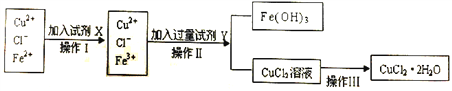
��1��������ʱ�����ȼ�����ʵ�����������Fe2+����ΪFe3+,���п�ѡ�õ���������__________��
A��KMnO4 B��H2O2 C��Cl2 D��HNO3
��2�������������Һ��pH��Y�Լ���ѡ�������е�__________��
A��NaOH(s) B����ˮ C��CuO(s) D��Cu(OH)2(s)
��3����֪�ܶȻ��������±���
���� | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
Ksp | 2.2��10-20 | 8.0��10-16 | 4.0��10-38 |
����Һ��pH����pH=4ʱ��ʹFe3+��ȫת��ΪFe(OH)3��������ȥ����ʱc(Fe3+)=__________��
��4������CuCl2��Һ���ɺ������գ��õ��Ĺ�����__________(�ѧʽ);���������CuCl2��2H2O����õ�������ˮCuCl2�ĺ���������_____________________________________��
���𰸡� E A ��С 80% BC CD 4.0��10-8molL-1 CuO �ڸ����HCl����������
����������1���ٴ�ͼ����Կ�����c=1.6mol����Ӧ��ƽ��״̬��ֻ��ʹ�ô�����ƽ���ƶ���Ӱ������ȷѡ�E��
�ڸ÷�Ӧ����ӦΪ���ȷ�Ӧ�������¶���ƽ��������c<1.6mol����ȷѡ�A������ƽ�����ƣ��¶����ߣ���Ӧ��Ũ������������Ũ�ȼ��٣��÷�Ӧ��ƽ�ⳣ�����٣���ȷ�𰸣����٣�
��2����÷�Ӧ�����ĵ���Ϊxmol, ��Ӧǰ�����������֮�ȵ���ѹǿ֮�ȣ�
3H2(g) + N2(g)![]() 2NH3(g)
2NH3(g)
��ʼ�� 3 1 0
�仯�� 3x x 2x
ƽ���� 3-3x 1- x 2x
p2/p1=(3-3x+1-x+2x)/ (3 +1)=0.6��x=0.8��ƽ��ʱ������ת����Ϊ0.8��1��100%=80%����ȷ��80%��
��1��A��KMnO4��Fe2+����ΪFe3+, ��������������������K+ ��Mn2+����������A������B��H2O2 �Ļ�ԭ������ˮ����һ����ɫ��������B��ȷ��C��Cl2�ܰ�Fe2+����ΪFe3+,
������ΪCl-��û�������������ӣ�C��ȷ��D��HNO3�Ļ�ԭ�����ǵ������������Ի�����Σ����D��������ȷ��ѡ��BC��
��2��������Һ��pHʱ��Ҫ�������к����ͬʱ�����������������ӽ�����Һ�У� ʣ������ʻ����ڳ�ȥ��CuO ��Cu(OH)2���ֹ��嶼������ˮ�����ܹ����������ܹ��ﵽ���ص�Ŀ������ȷѡ����C D��
��3������Ksp=c(Fe3+)c3 (OH-)��pH����pH=4��c(H+)=10-4, c(OH-)=10-10�����빫ʽ��
4.0��10-38= c(Fe3+)��c3 (OH-)= c(Fe3+)��10-30��c(Fe3+)=4.0��10-8molL-1����ȷ��4.0��10-8molL-1��
��4���Ȼ�ͭ��Һˮ�⣺CuCl2+2H2O![]() Cu(OH)2+2HCl����Һ���ɺ��Ȼ���ӷ���������������ͭ�õ��Ĺ���������ͭ�������Ȼ�ͭ��Һ����ˮ�⣬ֻ���ڲ���ͨ���Ȼ�������������£������Ȼ�ͭ��ˮ�⣬�����ڼ������ɵ�����µõ���������ˮCuCl2 ������
Cu(OH)2+2HCl����Һ���ɺ��Ȼ���ӷ���������������ͭ�õ��Ĺ���������ͭ�������Ȼ�ͭ��Һ����ˮ�⣬ֻ���ڲ���ͨ���Ȼ�������������£������Ȼ�ͭ��ˮ�⣬�����ڼ������ɵ�����µõ���������ˮCuCl2 ������
��ȷ�𰸣�CuO ���ڸ����HCl������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����
A. ��״���£�22.4LNO��11.2LO2��ַ�Ӧ��õ������������ΪNA
B. 3.6g��ˮ�к��е�������Ϊ2 NA
C. �����£�1L1mol��L-1��CH3COOH��Һ�У��������ʷ�����С��NA
D. һ�������£�6.4gͭ���������Ӧ��ת�Ƶ�����ĿΪ0.2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. lL 1mol/LNa2CO3��Һ�У�CO32-��������ΪNA
B. 1LpH=2 ��������ˮ�У�����������Ϊ0.01NA
C. C��ŨH2SO4��������4.48LCO2���壮ת�Ƶĵ�����Ϊ0.4NA.
D. 7.lg37Cl2�к����ȷ���0.lNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�����ʽ���м��㣺
(1)��״���£���4g������ ��33.6L���飨CH4���� ��6.02��1024��ˮ���ӡ���1mol NH3�У�
�������ɴ�С��˳��Ϊ ____________________������ţ���ͬ��������ԭ����������_________�����������____________��
(2)�ֽ�200 mL 0.30 mol/L��������50 mL 0.80 mol/L CaCl2��Һ���(��Ϻ�����仯���Բ���)��
������Һ��Cl�������ʵ���Ũ����_____________________��
(3)��֪224L��״���µ�HCl������ȫ����1Lˮ���ܶ�Ϊ1g/cm3���õ��ܶ�Ϊ1.1g/cm3�����ᣬ����������ʵ���Ũ��Ϊ��__________________ ������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʺͷǵ�����ǶԻ������һ�ַ��ʽ�����й��ڵ���ʵ�˵����ȷ����(����)
A. Һ̬HCl�����磬����HCl���ǵ����
B. CO2����ˮ�γɵ���Һ�ܵ��磬����CO2�ǵ����
C. SO2����ˮ�ܵ��磬����SO2�ǵ����
D. BaSO4��ˮ��Һ���ѵ��磬������״̬���ܵ��磬����BaSO4�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ�˲ⶨij���ᾧ��Ĵ������������ʵ�顣��ѧ��Ӧ���£�KMnO4+H2C2O4+H2SO4��K2SO4+MnSO4+CO2��+H2O(δ��ƽ)ʵ����Ҫ�������£�
��ȡ2.8g���ᾧ��(H2C2O4��2H2O)���100mL������Һ
��ȡ25.00ml������Һ����ƿ�У���������ϡ���ᣬ��0.1000mol��L-1���Ը��������Һ�ζ�������KMnO4��Һ20.00mL��

��������ʵ�鲽����ش��������⣺
��1�����������ҺӦʢװ��__________ (��ס����ҡ�)�ζ��ܡ�
��2���ζ������յ���жϱ�־��_________________________________��
��3��������ɲ��ᾧ����������ƫ�ߵ���__________��
A���ζ��յ����ʱ���� B���ζ�ǰ�����ݣ��ζ���������ʧ
C����ϴ��ƿ D�����������м�����������ˮ��ϴƿ��
��4��������Ը��������Һ��H2C2O4(��֪����Ϊ����)��Һ��Ӧ�����ӷ���ʽ��__________________��
��5���ò��ᾧ�����������Ϊ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5�ֻ����Һ���ֱ��ɵ����0.1mol/L��������Һ��϶���:
(1)CH3COONa��NaHSO4 (2)CH3COONa��NaOH�� (3)CH3COONa��NaCl
(4)CH3COONa��NaHCO3 (5)CH3COONa��NaHSO3
���и���������ȷ����( )
A. pH:(2)>(4)>(5)>(3)>(1) B. c(CH3COOH):(1)>(3)>(5)>(4)>(2)
C. c(CH3COO-):(2)>(3)>(4)>(5)>(1) D. 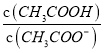 ��(1)>(5)>(3)>(4)>(2)
��(1)>(5)>(3)>(4)>(2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ������(�ס��ҡ��������е���������)�����պϸ�װ�õĵ��Kʱ���۲쵽��������ָ�뷢����ƫת��
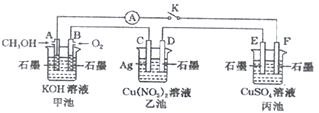
��ش���������:
(1)�׳�Ϊ_________(�ԭ��ء��������ء���Ƴء�)��A�缫�ĵ缫��ӦʽΪ______��
(2)������F�缫Ϊ____(�����������������������������������)���ó��ܷ�Ӧ�ķ���ʽΪ_____��
(3)���ҳ���C����������4.32gʱ���׳���B�缫����������O2�����Ϊ_____mL(��״��)��
(4)һ��ʱ��Ͽ����K������������ʹ�ҳػָ�����ӦǰŨ�ȵ���______(����ĸ)��
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)�״����Ҵ���������ȼ�ϡ���֪�Ҵ�Һ����ȫȼ������CO2�����1molҺ̬ˮʱ�ų�����453.3kJ����д���Ҵ�ȼ�յ��Ȼ�ѧ����ʽ:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ�����£�C2H8N2����һ�ָ���ȼ�ϣ�ȼ�ղ����ľ���������Ϊ�������ػ�����ƶ�����������������ȷ���ǣ� ��
A. ƫ�����£�C2H8N2����Ħ������Ϊ60g/mol
B. 6.02��1023��ƫ�����·��ӵ�����Ϊ60g
C. 1 molƫ�������й�����12molԭ��
D. 6 gƫ�����º���NA��ƫ�����·���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com