
| A、标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | ||
B、标准状况下,2.24L氯气中含有的
| ||
| C、常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | ||
| D、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
35 17 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、CO2溶于水得到的溶液能导电,则CO2属于电解质 |
| B、电解需要通电才能进行 |
| C、氯化氢的水溶液能导电,液态氯化氢不能导电 |
| D、NaCl晶体不能导电,所以NaCl是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol |
| B、0.5 mol |
| C、0.25 mol |
| D、0.15 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,1 mol O2与1 mol CCl4的体积相同 |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、在相同条件下,相同体积的CO、N2的混合气体与氢气的分子数、原子数都相同 |
| D、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag |
| B、在硫酸铜溶液中加入足量氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C、碳酸钠与稀硫酸混合,CO32-+2H+=CO2↑+H2O |
| D、铁溶解于稀盐酸:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应及其离子方程式 | 评价 | |
| A | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸:CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属晶体和离子晶体都能导电 |
| B、冰、“可燃冰”、干冰都具有分子密堆积特征 |
| C、金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 |
| D、金属晶体和离子晶体中分别存在金属键和离子键,很难断裂,都具有延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
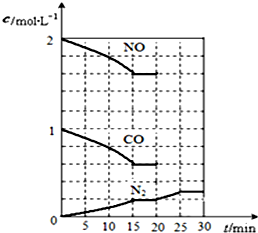 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com