
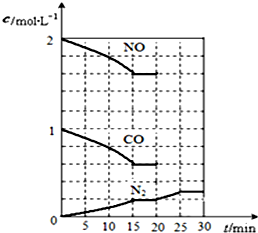
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
| [N2]?[CO2]2 |
| [CO]2?[NO]2 |
| [N2]?[CO2]2 |
| [CO]2?[NO]2 |


科目:高中化学 来源: 题型:
| A、标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | ||
B、标准状况下,2.24L氯气中含有的
| ||
| C、常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | ||
| D、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
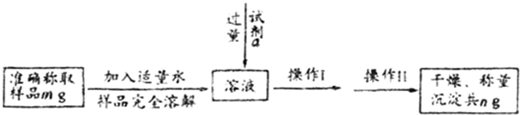
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
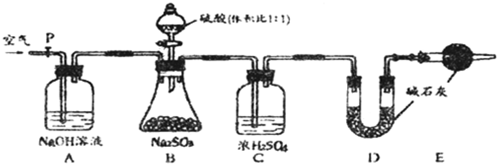
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16g | B、23.4g |
| C、31g | D、无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com