
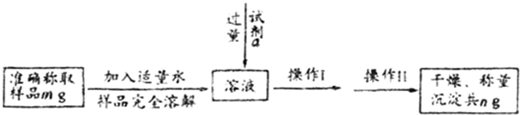
m-
| ||
| m |
m-
| ||
| m |
| ng |
| 64g/mol |
| ||
| mg |
| 126n |
| 64m |
| 126n |
| 64m |


科目:高中化学 来源: 题型:
| A、在标准状况下,1 mol O2与1 mol CCl4的体积相同 |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、在相同条件下,相同体积的CO、N2的混合气体与氢气的分子数、原子数都相同 |
| D、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
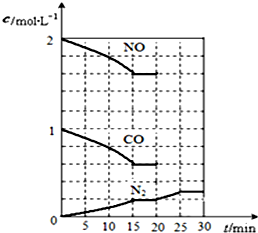 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgCl2溶液中加入一粒绿豆大小的Na |
| B、饱和Ca(OH)2溶液中加入一粒绿豆大小的Na |
| C、CuSO4溶液中加入一粒绿豆大小的Na |
| D、水中加入一粒绿豆大小的Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
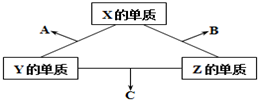 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4 溶解度增大、Ksp不变 |
| B、BaSO4 溶解度、Ksp均增大 |
| C、BaSO4 溶解度不变、Ksp增大 |
| D、BaSO4 溶解度、Ksp均不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com