
 ,故答案为:
,故答案为: ;
;| 23 |
| 23 |
| 9 |
| 27 |
| 38 |
| 19 |
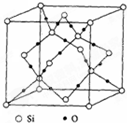 ,故答案为:16.
,故答案为:16.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
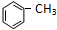 +Cl2
+Cl2| 光 |
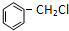 +HCl ②R-CH2-CH=CH2+Cl2
+HCl ②R-CH2-CH=CH2+Cl2| 500~600℃ |
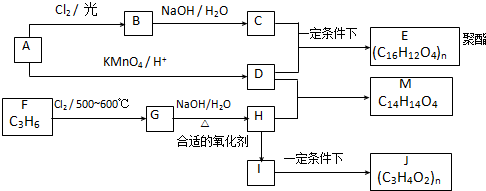
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 原子结构和性质 |
| X | X原子在短周期中原子半径最大(稀有气体除外) |
| Y | 基态原子有3个不同的能级,各能级中电子数相等 |
| Z | 其气态氢化物与其最高价氧化物的水化物化合生成离子化合物 |
| W | 原子核外s能级电子总数等于p能级电子总数,能形成W2和W3两种单质 |
| T | 地壳含量最高的金属元素 |
| R | R的一种阳离子遇苯酚溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
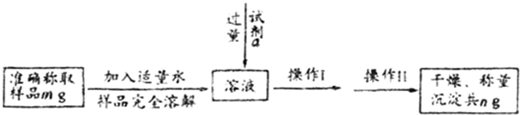
查看答案和解析>>
科目:高中化学 来源: 题型:
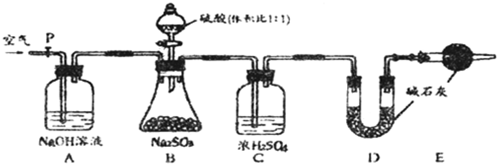
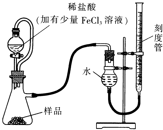 镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3n |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com