
| A、1 mol |
| B、0.5 mol |
| C、0.25 mol |
| D、0.15 mol |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、方案甲:试液
| ||||
B、方案乙:试液
| ||||
C、方案丙:试液
| ||||
D、方案丁:试液
|
查看答案和解析>>
科目:高中化学 来源: 题型:
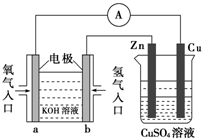
| A、左边的装置是电解池,右边的装置是原电池 |
| B、该装置中铜为正极,锌为负极 |
| C、当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| D、装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应均为氧化还原反应 |
| B、液氨、液氯、液体氯化氢都是非电解质 |
| C、多糖、油脂、蛋白质都是高分子化合物 |
| D、古代的陶瓷、砖瓦,现代的玻璃、水泥等,都是硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200 mL 2 mol?L-1 MgCl2溶液 |
| B、1000 mL 2.5 mol?L-1 NaCl溶液 |
| C、250 mL 1 mol?L-1 AlCl3溶液 |
| D、300 mL 5 mol?L-1 KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | ||
B、标准状况下,2.24L氯气中含有的
| ||
| C、常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | ||
| D、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两位美国科学家和一位德国科学家因研制出超分辨率荧光显微镜而共享了2014年诺贝尔化学奖 |
| B、大雾天气常造成机场封闭、飞机航班延误,气象中的雾属于胶体 |
| C、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 |
| D、同位素的应用已遍及各个领域,在医疗上利用同位素的放射性治疗肿瘤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com