
| A、两位美国科学家和一位德国科学家因研制出超分辨率荧光显微镜而共享了2014年诺贝尔化学奖 |
| B、大雾天气常造成机场封闭、飞机航班延误,气象中的雾属于胶体 |
| C、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 |
| D、同位素的应用已遍及各个领域,在医疗上利用同位素的放射性治疗肿瘤 |


科目:高中化学 来源: 题型:
| A、1 mol |
| B、0.5 mol |
| C、0.25 mol |
| D、0.15 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag |
| B、在硫酸铜溶液中加入足量氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C、碳酸钠与稀硫酸混合,CO32-+2H+=CO2↑+H2O |
| D、铁溶解于稀盐酸:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应及其离子方程式 | 评价 | |
| A | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸:CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属晶体和离子晶体都能导电 |
| B、冰、“可燃冰”、干冰都具有分子密堆积特征 |
| C、金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 |
| D、金属晶体和离子晶体中分别存在金属键和离子键,很难断裂,都具有延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
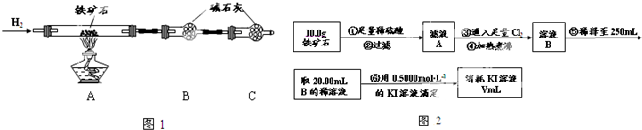
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 mol SO3 |
| D、3 mol SO2+1 mol SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com