
| A、NH4HSO3溶液与过量的NaOH溶液混合:NH4++OH-═-NH3?H2O |
| B、Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
| C、向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |


科目:高中化学 来源: 题型:
| A、溶液的质量将增大 |
| B、溶质的物质的量浓度增大 |
| C、溶液中的金属离子全部是Fe2+ |
| D、溶液中的金属离子既有Fe3+,又有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点、沸点:F2>Cl2>Br2>I2 |
| B、离子半径:F->Na+>Mg2+>Al3+ |
| C、碱性:LiOH>NaOH>KOH>RbOH |
| D、Na2CO3水溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干细铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的细铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的细铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(细铁丝完全浸没在食盐水中) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
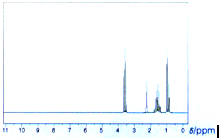 0.60g某饱和一元醇A,与足量的金属钠反应,生成氢气112mL(标准状况).求该一元醇的分子式
0.60g某饱和一元醇A,与足量的金属钠反应,生成氢气112mL(标准状况).求该一元醇的分子式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com