
【题目】将5.6 g铁粉投入足量的100 mL 2 mol·L-1稀硫酸中,2 min时铁粉刚好完全溶解。下列有关这个反应的反应速率表示正确的是( )
A. 铁的反应速率=0.5 mol·L-1·min-1
B. 硫酸的反应速率=0.25 mol·L-1·min-1
C. 硫酸亚铁的生成速率=0.5 mol·L-1·min-1
D. 氢气的反应速率=0.5 mol·L-1·min-1
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
A.放电时,Cd作负极
B.放电时,NiO(OH)作负极
C.电解质溶液为碱性溶液
D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
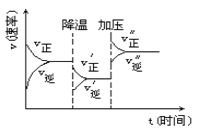
A. 正反应是放热反应
B. A、B一定都是气体
C. D一定不是气体
D. C可能是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和气态烯烃组成的混合物共10 g,混合气体的密度是相同状况下氢气密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4 g,该混合气体的组分可能是( )
A. 乙烯和乙烷B. 乙烷和丙烯C. 甲烷和乙烯D. 丙烯和丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水电离情况的说法正确的是
A. 25℃,pH=12 的烧碱溶液与纯碱溶液,水的电离程度相同
B. 其它条件不变,CH3COOH溶液在加水稀释过程中,c(OH-)/c(H+)一定变小
C. 其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D. 其它条件不变,温度升高,水的电离程度增大,Kw 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丁炔二醇可以制备1,3-丁二烯。请根据下面的合成路线图填空:
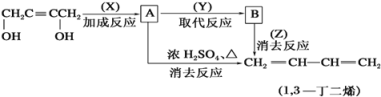
(1)写出各反应的反应条件及试剂:X____________;Y____________;Z_____________。
(2)写出A、B的结构简式:A____________________;B____________________。
(3)写出生成1,3-丁二烯的化学方程式:
①由A生成:_______________________________________________________。
②由B生成:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于稀有气体的叙述不正确的是
A.原子的最外电子层都有8个电子
B.其原子与同周期IA、IIA族阳离子具有相同的核外电子排布
C.化学性质非常不活泼
D.不能形成双原子分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com