
【题目】氮的化合物在化肥、医药、炸药、材料等领域中有着极其重要用途。
(1)羟氨能与溴化银悬浊液反应:2NH2OH+2AgBr=N2↑+2Ag+2HBr+2H2O,羟氨的电子式为________;反应中烃氨表现________性.
(2)已知:a.N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol
b.H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/mol
c.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) △H3
①△H3________.
②反应c在常温下能快速进行的原因为________.
(3)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器.相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)≒N2O4(g) △H<0,甲中NO2的相关量随时间变化如下图所示。
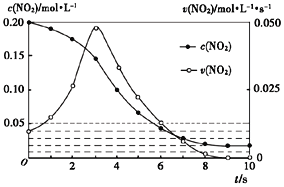
①0~3S内,甲容器中NO2的反应速率增大的原因是________.
②甲达平衡时,温度若为T℃,此温度下的平衡常数Kc=________.
③平衡时,K甲________K乙(填“>”、“<”或“=”,下同),P甲________P乙
(4)化学工作者对NO与H2的反应进行研究,提出下列3步机理:(k为速率常数)
第一步2NO=N2O2 快反应,平衡时:V正=K正·c2(NO)=V逆=K逆·c(N2O2)
第二步N2O2+H2==N2O+H2O 慢反应 第三步N2O+H2=N2+H2O 快反应
其中可近似认为第二步反应不影响第一步平衡,下列说法正确的是________.(填字母标号)
A.V(第一步逆反应)<V(第二步反应) B.总反应快慢主要由第二步反应决定
C.达平衡时,2c(NO)=c(N2O2) D.第一步反应的平衡常数K= K正/ K逆
【答案】![]() 还原 -461.6 kJ/mol 该反应的活化能较小或反应物分子中共价键的键能较小 0-3s内温度升高对速率的影响大于浓度降低的影响 225 < > BD
还原 -461.6 kJ/mol 该反应的活化能较小或反应物分子中共价键的键能较小 0-3s内温度升高对速率的影响大于浓度降低的影响 225 < > BD
【解析】
第(1)问中由羟氨结构写出电子式,结合化合价变化确定其性质;第(2)问从盖斯定律计算分析;第(3)(4)问为平衡常数计算,及影响平衡因素进行分析。
(1)由其分子式可推出电子式为![]() ,反应中N化合价升高,烃氨表现还原性;
,反应中N化合价升高,烃氨表现还原性;
(2)①设a式反应热为△H1,b式反应热为△H2,则由盖斯定律,△H3=3△H2-△H1=-184.6×3-(-92.2)=-461.6 kJ/mol;②常温下能快速进行,其原因可能是该反应的活化能较小或反应物分子中共价键键能较小;
(3)①该反应为放热反应,故0-3s内温度升高对速率的影响大于浓度降低的影响,导致反应速率增大;②到达平衡时,c(NO2)=0.02mol/L,c(N2O4)=0.09mol/L,K=0.09/0.022=225;③甲为绝热容器,乙为恒温容器,该反应为放热反应,则到达平衡时甲的温度高于乙,故K甲<K乙,甲中反应正向进行的程度小于乙,甲中气体的总物质的量大于乙,故P甲>P乙;
(4)A.第二步为慢反应,故其反应速率应小于第一步,A项错误;总反应快慢应由慢反应决定,即主要由第二步反应决定,B项正确;C. 到达平衡时K正·c2(NO)=K逆·c(N2O2),K正、K逆值未知,故两者浓度大小关系未知,C项错误;D.达到平衡时,K= c(N2O2)/ c2(NO),又V正=K正·c2(NO)=V逆=K逆·c(N2O2), 故K= K正/ K逆,D项正确。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.46g N2O4气体中含有的原子数为3NA
B.标准状况下,22.4L SO3中含有SO3分子数为NA
C.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.用电解法精炼铜的反应中转移0.2NA个电子时,阳极溶解6.4g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________,能量最高能级的电子云形状为_________。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________,写出一个与SCN-具有相同空间构型的分子:_________。
(3)氮元素的最简单氢化物为氨,氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是_________。氮元素另一种氢化物联氨(N2H4)是_________(填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨是一种混合型晶体,具有多种晶体结构其一种晶胞的结构如图所示。回答下列问题:

(1)基态碳原子的轨道表示式为___________;
(2)碳、氮、氧三种元素的第一电离能由大到小的顺序为___________;
(3)CH3-是有机反应中重要的中间体,其空间构型为___________;
(4)石墨晶体中碳原子的杂化形式为___________晶体中微粒间的作用力有___________(填标号),石墨熔点高于金刚石是因为存在___________(填标号);
A.离子键 B.共价键 C.π键 D.氢键 E范德华力
(5)该晶胞中的碳原子有___________种原子坐标;若该晶胞底面边长为apm,高为cpm,则石墨晶体中碳碳键的键长为___________pm,密度为___________g·cm-3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是

A. 反应的化学方程式为2X = 3Y + Z
B. t时,X的转化率达66.7%
C. 若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D. 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。

已知:i. PbCl2微溶于水ii. PbCl2 (s) + 2Cl-(aq) ![]() PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0
(1)浸取过程中MnO2与PbS发生如下反应,请将离子反应配平:
___ ____+ ___ ____+___PbS + ___MnO2 ____PbCl2 + ____ ____+ ____ ____+ ___ ____
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是________。
(3)调pH的目的是________。
(4)沉降池中获得PbCl2采取的措施有________。
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:

①在_______极(填“a”或“b”)获得MnO2,电极反应为________。
②电解过程中发现有Cl2产生,原因可能是_________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com