
| A. | 该溶液中,Na+、Cl-、S2-和SO42-可以大量共存 | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合,反应的离子方程式为:HSO3-+OH-=SO32-+H2O | |
| C. | NH4HSO3为弱酸弱碱盐,其水溶液pH>7 | |
| D. | c(NH4+)>c(HSO3-)>c(SO32-)>C(H2SO3)>C(NH3•H2O) |
分析 H2SO3电离常数Ka1=1.4×10-2、Ka2=6.3×10-4,NH3•H2O的常数Kb=1.8×10-3>Ka1=1.4×10-2,说明亚硫酸电离程度大于一水合氨的电离程度,则NH4HSO3溶液呈酸性,HSO3-的水解平衡常数为:$\frac{{K}_{w}}{{K}_{a1}}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-2}}$=10-12,NH4+的水解平衡常数为:$\frac{{K}_{w}}{{K}_{b}}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$=10-11,
A.硫离子与亚硫酸氢根离子反应;
B.亚硫酸氢根离子优先结合氢氧根离子;
C.铵根离子水解、亚硫酸氢根离子的电离程度大于其水解程度,所以其溶液呈酸性;
D.铵根离子的水解程度大于亚硫酸氢根离子,则c(NH3•H2O)>c(H2SO3).
解答 解:H2SO3电离常数Ka1=1.4×10-2、Ka2=6.3×10-4,NH3•H2O的常数Kb=1.8×10-3>Ka1=1.4×10-2,说明亚硫酸电离程度大于一水合氨的电离程度,则NH4HSO3溶液呈酸性,HSO3-的水解平衡常数为:$\frac{{K}_{w}}{{K}_{a1}}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-2}}$=10-12,NH4+的水解平衡常数为:$\frac{{K}_{w}}{{K}_{b}}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$=10-11,
A.S2-与NH4HSO3电离出的亚硫酸氢根离子反应,在溶液中不能大量共存,故A错误;
B.含等物质的量的NH4HSO3与NaOH溶液混合,亚硫酸氢根离子优先与氢氧化钠反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O,故B正确;
C.NH4HSO3为弱酸弱碱盐,由于亚硫酸氢根离子的电离程度大于其水解程度,铵根离子水解导致其水溶液显示酸性,溶液的pH<7,故C错误;
D.由于铵根离子的水解程度需要亚硫酸氢根离子的电离程度,则c(NH4+)>c(HSO3-),且亚硫酸氢根离子的水解程度远远需要铵根离子的水解程度,则c(NH3•H2O)>c(H2SO3),混合液中正确的离子浓度大小为:c(NH4+)>c(HSO3-)>c(SO32-)>c(NH3•H2O)>c(H2SO3),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,正确比较水解程度、电离程度大小为解答关键,注意掌握盐的水解原理及其应用,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
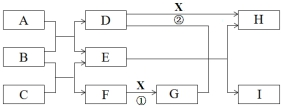
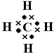 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
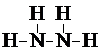 .
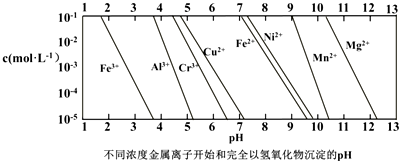
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏 | B. | 分液 | C. | 重结晶 | D. | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别是丁达尔效应 | |
| B. | 液氨、氨水属于纯净物,盐酸和豆浆属于混合物 | |
| C. | 胶体区别于其它分散系的本质特征是粒子大小 | |
| D. | 能进行“交叉分类”的就不能进行“树状分类” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 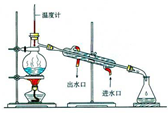 用如图装置分离甲苯和水 | |
| B. | 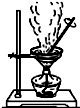 蒸干NH4Cl溶液制备NH4Cl晶体 | |
| C. | 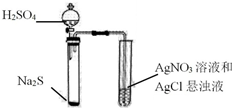 证明Ag2S溶解度小于AgCl | |
| D. | 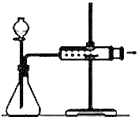 关闭分液漏斗活塞,向外拉动针筒活塞,松开后活塞恢复原位置,证明装置气密性良好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com