
| 催化剂 |
| 加热 |
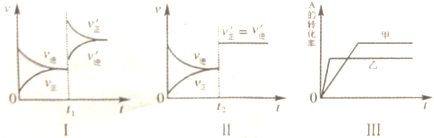
| A、图Ⅰ表示的是t1时刻增大B的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t2时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |


科目:高中化学 来源: 题型:
| A、如果苯酚浓溶液沾到皮肤上,应立即用酒精洗涤 |
| B、在点燃H2、CH4等易燃性气体前,必须检验气体的纯度 |
| C、实验室蒸馏原油时,要加入碎瓷片防止液体暴沸 |
| D、石油的分馏时,温度计的水银球要插到液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时,负极上发生反应的物质是NiO2 |
| B、放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C、充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D、充电时,阳极附近pH值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+ Na+ NO3- Cl- |
| B、K+ Na+ Cl- NO3- |
| C、K+ Na+ Cl- HCO3- |
| D、K+ Fe2+ SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
106 46 |
| A、质量数为46 |
| B、质子数为106 |
| C、电子数为46 |
| D、中子数为106 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com