
| A、MgCl2晶体 |
| B、熔融的NaCl |
| C、液态酒精 |
| D、KOH溶液 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、①③ | B、②⑤ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
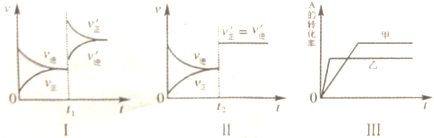
| A、图Ⅰ表示的是t1时刻增大B的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t2时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
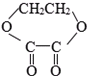 ⑤
⑤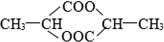 ⑥
⑥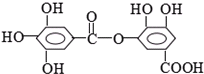
| A、①②⑤ | B、④⑤ |
| C、①⑤⑥ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2F2+2H2O=4HF+O2 | ||||
| B、AgNO3+NaCl=AgCl↓+NaNO3 | ||||
C、3CO+Fe2O3
| ||||
D、MgCl2 (熔融)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Na2CO3溶液作洗涤剂:CO32-+2H2O?H2CO3+2OH- | ||||
B、用铜作电极电解氢氧化钠溶液:2H2O
| ||||
C、“银镜反应”:RCHO+2Ag(NH3)2++2OH-
| ||||
| D、交警用酸化的含Cr2O72-的硅胶检测司机酒后驾驶的反应:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(NO2)/mol | n(NH3)/mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | 0.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com