
| 1 |
| 10 |
| 1 |
| 10 |
| 0.01×126 |
| 6 |


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
| C、Tl3+核外有6个电子层 | ||||
| D、Tl原子半径大于Cs原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:
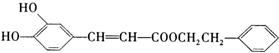 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化: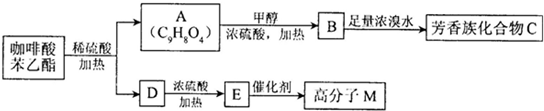
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测得醋酸钠溶液的pH>7 |
| B、测得0.1mol/L醋酸溶液的pH=3.3 |
| C、将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D、将等浓度、等体积的醋酸溶液与氢氧化钠溶液混合后恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去.后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等有毒气体并发现在200m深的湖底,每立方米湖水竟溶解8m3的有毒气体,目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理.回答:
喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去.后经科学家考察发现,湖底有火山口,聚集了大量二氧化碳和二氧化硫等有毒气体并发现在200m深的湖底,每立方米湖水竟溶解8m3的有毒气体,目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理.回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=14的溶液:Na+、AlO2-、CO32- |
| B、pH=1的溶液:Fe2+、Mg2+、NO3- |
| C、含Fe3+的溶液:NH4+、HCO3-、Cl- |
| D、由水电离出的c(H+)=1×10-13mol/L溶液:S2-、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氧气运输到血液 |
| B、将体内代谢的废物通过尿液或粪便排出体外 |
| C、营养素的消化、吸收过程不需要水的作用 |
| D、通过蒸发或出汗来调节体温保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com