
【题目】(1)25℃时,0.005mol/LH2SO4溶液的pH=______ ,0.001mol/LNaOH溶液的pH=______ 。
(2)某温度下纯水的c(H+)=2.0×10-7mol/L,则此溶液中的c(OH-)=_______;若温度不变,滴入稀盐酸,使c(H+)=5.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=_________。
【答案】 2 11 2.0×10-7mol/L 8.0×10-11mol/L
【解析】硫酸为二元强酸,0.005mol/L硫酸溶液c(H+)=2c(H2SO4)=0.01mol/L,溶液的pH=-lgc(H+)= -lg0.01=2;氢氧化钠为一元强碱,0.001mol/LNaOH溶液c(OH-)=c(NaOH)=0.001mol/L,c(H+)c(OH-)=1×10-14,c(H+)=![]() =10-11mol/L,pH=-lgc(H+)=11,故答案为:2;11;
=10-11mol/L,pH=-lgc(H+)=11,故答案为:2;11;
(2)某温度下纯水中的c(H+)=2×10-7mol/L,则此时溶液中的c(OH-)=2×10-7mol/L;若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中c(H+)c(OH-)=4×10-14;c(OH-)=8×10-11mol/L,此时溶液中由水电离产生的c(H+)=8×10-11mol/L,故答案为:2×10-7mol/L;8×10-11mol/L。


科目:高中化学 来源: 题型:
【题目】下列电离方程式中书写正确的是( )
A. NaHSO4![]() Na++H++SO42- B. NaHCO3
Na++H++SO42- B. NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C. HClO=H++ClO- D. H2S![]() H++HS-;HS-
H++HS-;HS-![]() H++S2-
H++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
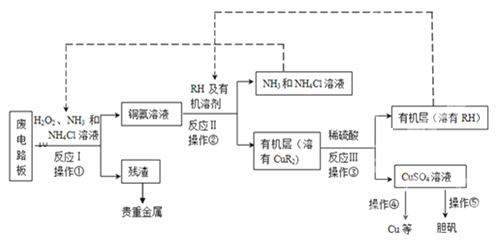
回答下列问题:
(1)反应I是将Cu转化为Cu(NH3)42+,反应中H2O2 的作用是_________________。请写出操作①的名称:________________。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,请写出该反应的离子方程式:_________________。操作②用到的主要仪器名称为___________,其目的是(填序号)__________。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应III除了生成CuSO4之外,还生成另外一种产物是___________。
(4)操作④以石墨作电极电解CuSO4溶液,电解时的总反应式为________________。操作⑤由硫酸铜溶液制胆矾的主要步骤是___________________________________。
(5)流程中有三次实现试剂的循环使用,已用虚线标出两处,第三处的试剂是______。循环使用的NH4Cl在反应I中的主要作用是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g) ![]() O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
C.氢气的燃烧热为241.8 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是( )
A. 铁、金属活动性顺序 B. 金、质量守恒定律
C. 银、质量守恒定律 D. 铜、金属密度顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明氯的非金属性比硫强的反应是( )
A. CuCl2+H2S===CuS↓+ 2HCl
B. Cl2+ H2S===2HCl+ S
C. 3Cl2+6FeSO4===2Fe2(SO4)3+2FeCl3
D. H2SO4(浓)+ NaCl(固)===NaHSO4+ HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学-化学与技术〕
工业中以铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)为原料冶炼铝过程如图所示:

(1) 实验室进行过滤用到的玻璃仪器有烧杯、_____________、_____________。
(2) 操作II中生成不溶物C的离子方程式是 。
(3) 氧化铝的熔点高达2050℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是 。
(4) 电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是 。
(5) 为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:
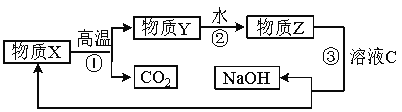
① 上述转化中未涉及四种基本反应类型中的 反应;
② 写出过程③的化学方程式: 。
(6) 研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有_____个,化合物乙中采取sp3方式杂化的原子对应元素的电负性由大到小的顺序为_____。
(3)某含Ti3+配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配合物离子中含有的化学键类型是_____,1 mol该配合物中含有的σ键数目是_____。
(4)通过x-射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_____。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.469 nm,c=0.295 nm,则该钛晶体的密度为______g·cm-3(用NA 表示阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com