
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有_____个,化合物乙中采取sp3方式杂化的原子对应元素的电负性由大到小的顺序为_____。
(3)某含Ti3+配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配合物离子中含有的化学键类型是_____,1 mol该配合物中含有的σ键数目是_____。
(4)通过x-射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_____。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.469 nm,c=0.295 nm,则该钛晶体的密度为______g·cm-3(用NA 表示阿伏加德罗常数的值,列出计算式即可)。

【答案】 3d24s2 7 O>N>C 配位键、极性共价键 18 NA TiN>MgO>CaO>KCl 
【解析】试题分析:(1)Ti是22号元素,原子核外有22个电子,3d、4s是其外围电子,根据核外电子排布规律写价电子排布式;(2)化合物甲的分子中采取sp2方式杂化的碳原子价电子对数是3;化合物乙中采取sp3方式杂化的原子有C、N、O,同周期元素电负性逐渐增大;(3) [TiCl(H2O)5]Cl2·H2O配合离子是[TiCl(H2O)5]2+,该离子的配位体是Cl-和H2O;单键是σ键、双键、三键中各有1个σ键;(4)离子带的电荷越多,晶格能越大,离子半径越小晶格能越大,晶格能越大晶体沸点越高;(5)根据均摊法,该晶胞含有的原子数是![]() ,一个晶胞的体积是
,一个晶胞的体积是![]() ;
;
解析:(1)Ti是22号元素,原子核外有22个电子,3d、4s是其外围电子,根据核外电子排布规律,价电子排布式3d24s2;(2)化合物甲的分子中采取sp2方式杂化的碳原子价电子对数是3,苯环上的碳原子、羰基上的碳原子都是sp2方式杂化,共7个;化合物乙中采取sp3方式杂化的原子有C、N、O,同周期元素电负性逐渐增大,所以电负性由大到小的顺序为O>N>C;(3) [TiCl(H2O)5]Cl2·H2O配合离子是[TiCl(H2O)5]2+,该离子的配位体是Cl-和H2O,含有的化学键类型是配位键、极性共价键;单键是σ键、双键、三键中各有1个σ键,1 mol该配合物中含有的σ键数目是18NA;(4)离子带的电荷越多,晶格能越大,离子半径越小晶格能越大,晶体沸点越高,所以晶体熔点由高到低的顺序为TiN>MgO>CaO>KCl;(5)根据均摊法,该晶胞含有的原子数是![]() ,一个晶胞的体积是
,一个晶胞的体积是![]() ;所以密度是
;所以密度是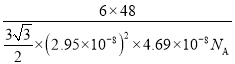 。
。


科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.005mol/LH2SO4溶液的pH=______ ,0.001mol/LNaOH溶液的pH=______ 。
(2)某温度下纯水的c(H+)=2.0×10-7mol/L,则此溶液中的c(OH-)=_______;若温度不变,滴入稀盐酸,使c(H+)=5.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如右图所示。下列表述不正确的是
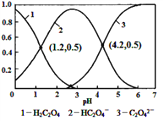
A. HC2O4-![]() H++C2O42-,K=1×10-4.2
H++C2O42-,K=1×10-4.2
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.2
C. 常温下HF的K=1×10-3.4,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D. 在0.1 mol/L NaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。从缺乏仪器的角度看,不能进行的实验项目是( )
A. 蒸发B. 萃取C. 液体过滤D. 升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)2NH3(g)
(1)若反应进行到某时刻t时,n1(N2)=13mol,n1(NH3)=6mol,计算a的值.
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同).n1(始):n1(平)= .
(4)原始混合气体中,a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5 , 它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.NH5中既有共价键又有离子键
B.NH5的电子式为 ![]()
C.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数)
D.它与水反应的离子方程式为NH4++H﹣+H2O═NH3H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大海航行中的海轮船壳上连接了锌块,说法错误的是
A.船体作正极B.属牺牲阳极的阴极保护法
C.船体发生氧化反应D.锌块的反应:Zn-2e-→Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com