
【题目】下列叙述正确的是( )
A. 1molOH-的质量为17g
B. 二氧化碳的摩尔质量为44g
C. 铁原子的摩尔质量等于它的相对原子质量
D. 标准状况下,1mol 任何物质的体积均为22.4L
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
甲 乙
乙 丙
丙 丁
丁
A. 装置甲中试剂X可以选择生石灰 B. 装置乙作为反应过程的安全瓶
C. 装置丙制备水合肼时氨气从b口进入 D. 装置丁可用于吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一套验证物质化学性质的实验装置(如图):

请观察该装置图,完成下列问题:
(1)该实验的目的是________________________。
(2)该实验的涉及的化学方程式有___________________。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称)_________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为______________;③关闭________,(填写K1或K2或K3)打开________,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g) △H>0,平衡体系中气体的平均摩尔质量(
2NO2(g) △H>0,平衡体系中气体的平均摩尔质量(![]() )在不同温度下随压强的变化曲线如图所示。下列说法正确的是
)在不同温度下随压强的变化曲线如图所示。下列说法正确的是

A. 温度:T1<T2 B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:v(b)>v(a) D. 当![]() =69g/mol时,n(NO2):n(N2O4)=2:1
=69g/mol时,n(NO2):n(N2O4)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置和方法进行相应实验,能达到实验目的的是
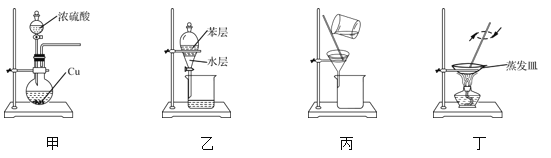
A. 用装置甲制备SO2
B. 用装置乙从碘水溶液中萃取碘
C. 用装置丙除去粗盐溶液中混有的KCl杂质
D. 用装置丁蒸干溶液获得(NH4)2CO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(CH3OCH3)被称为21世纪的新型燃料,工业上以CO和H2为原料生产二甲醚。已知:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ/mol
CH3OH(g) △H=-99kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-24 kJ/mol
CH3OCH3(g)+H2O(g) △H=-24 kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41 kJ/mol
H2(g)+CO2(g) △H=-41 kJ/mol
(1)反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)的△H=___________。
CH3OCH3(g)+H2O(g)的△H=___________。
(2)某温度下,将4.0molH2和4.0molCO充入容积为1L的密闭容器中,发生反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),5min时CO2的物质的量浓度为0.5mo1/L,10min后反应达到平衡状态,测得二甲醚的体积分数为25%。
CH3OCH3(g)+CO2(g),5min时CO2的物质的量浓度为0.5mo1/L,10min后反应达到平衡状态,测得二甲醚的体积分数为25%。
①5min时CO的转化率=___________;
②该温度下此反应的平衡常数K=___________;
③下列措施能提高 CH3OCH3平衡产率的有___________(填标号)。
A.分离出 CH3OCH3 B.升高温度 C.增大压强 D.改用高效催化剂
Ⅱ.液氨是一种良好的储氢物质
已知:2NH3(g)![]() N2(g)+3H2(g) △H=+92.4 kJ/mol
N2(g)+3H2(g) △H=+92.4 kJ/mol
其他条件相同时,反应在不同金属催化剂作用下进行相同时间后,氨的转化率[a(NH3)]随反应温度的变化情况如图所示。

(1)用___________作催化剂时,氨气分解反应的活化能最大。
(2)a点所代表的状态___________(填“是”或“不是”)平衡状态。
(3)c点时NH3的转化率高于b点时NH3的转化率,原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com