
【题目】当发动机工作时,反应产生的NO尾气是主要污染物之一,NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
(1)已知:2NO(g)+O2 (g) =2NO2(g) △H1= -113kJ/mol
6NO2(g)+O3(g)=3N2O5(g) △H2= -227 kJ/mol
4NO2 (g)+O2(g)=2N2O5(g) △H3= -57 kJ/mol
则 2O3(g)= 3O2(g)是_________反应(填“放热”或“吸热”),以上 O3氧化脱除氮氧化物的总反应是NO(g)+O3(g)=NO2(g)+O2(g) △H4=_______kJ/mol,最后将NO2与_________剂反应转化为无污染的气体而脱除。
步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
I | 2NO(g) | Ea1 |
|
|
II | N2O2(g)+O2(g) | Ea2 |
|
|
(2)已知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①表中k1、k2、k3、k4是只随温度变化的常数,温度升高将使其数值_____(填“增大”或“减小”)。
②反应I瞬间建立平衡,因此决定2NO(g)+O2(g)![]() 2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
③一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)的速率方程为
2NO2(g)的速率方程为![]() ,则k=_______ (用k1、k2、k3表示)。
,则k=_______ (用k1、k2、k3表示)。
(3)将一定量的 NO2放入恒容密闭容器中发生下列反应:2NO2(g) ![]() 2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

【答案】放热 -198 还原 增大 < 活化能低,同条件下单位体积内活化分子数多,有效碰撞几率大,速率快 ![]() 左 108kPa
左 108kPa
【解析】
(1) 根据盖斯定律计算反应热并判断反应为放热还是吸热反应;根据氧化还原反应规律,二氧化氮转化为氮气,氮元素化合价降低,需要加入还原剂与之反应;
(2) ①温度升高化学反应速率加快;
②反应I反应速率快,反应II反应速率慢,根据碰撞理论,活化能低,同条件下单位体积内活化分子数多,有效碰撞几率大,速率快;
③步骤I反应:2NO(g)![]() N2O2(g) ,
N2O2(g) ,![]() 1正=k1 c2 (NO),
1正=k1 c2 (NO),![]() 1逆=k2 c(N2O2),
1逆=k2 c(N2O2),
步骤II反应:N2O2(g)+O2(g)![]() 2NO2(g) ,
2NO2(g) ,![]() 2正=k3c(N2O2)c(O2),
2正=k3c(N2O2)c(O2),
步骤I反应+步骤II反应得总反应:2NO(g)+O2(g) ![]() 2NO2(g)
2NO2(g)
v正=![]() ×k3c(N2O2)c(O2)=
×k3c(N2O2)c(O2)=![]() ·c2 (NO)·c(O2)= k·c2 (NO)·c(O2);
·c2 (NO)·c(O2)= k·c2 (NO)·c(O2);
(3) 根据温度对化学平衡的影响分析平衡移动方向;列出三段式找出平衡时各组分的平衡分压,根据Kp= ![]() 计算。
计算。
(1) 已知: ①2NO(g)+O2 (g) =2NO2(g) △H1=-113kJ/mol
②6NO2(g)+O3(g)=3N2O5(g) △H2=-227 kJ/mol
③4NO2 (g)+O2(g)=2N2O5(g) △H3=-57 kJ/mol
根据盖斯定律②![]() 2-③
2-③![]() 3得④2O3(g)= 3O2(g) △H=-283kJ/mol,因△H<0,所以为放热反应;
3得④2O3(g)= 3O2(g) △H=-283kJ/mol,因△H<0,所以为放热反应;
根据盖斯定律(①+④)![]() 2得NO(g)+O3(g)=NO2(g)+O2(g) △H=[(-113kJ/mol)+(-283kJ/mol)]
2得NO(g)+O3(g)=NO2(g)+O2(g) △H=[(-113kJ/mol)+(-283kJ/mol)]![]() 2=-198 kJ/mol, 最后将NO2与还原剂反应转化为无污染的气体N2而脱除。
2=-198 kJ/mol, 最后将NO2与还原剂反应转化为无污染的气体N2而脱除。
故答案为:放热;-198;还原;
(2) ①温度升高化学反应速率加快, 所以温度升高将使k1、 k2、 k3、 k4值增大;
②反应I反应速率快,反应II反应速率慢。根据碰撞理论,活化能越低,则在相同条件下单位体积内活化分子数越多,有效碰撞几率就越大,化学反应速率就越快。 因此,反应
③步骤I反应:2NO(g)![]() N2O2(g) ,
N2O2(g) ,![]() 1正=k1 c2 (NO),
1正=k1 c2 (NO),![]() 1逆=k2 c(N2O2),
1逆=k2 c(N2O2),
步骤II反应:N2O2(g)+O2(g)![]() 2NO2(g) ,
2NO2(g) ,![]() 2正=k3c(N2O2)c(O2),
2正=k3c(N2O2)c(O2),
步骤I反应+步骤II反应得总反应:2NO(g)+O2(g) ![]() 2NO2(g)
2NO2(g)
v正=![]() ×k3c(N2O2)c(O2)=
×k3c(N2O2)c(O2)=![]() ·c2 (NO)·c(O2)= k·c2 (NO)·c(O2),故k =
·c2 (NO)·c(O2)= k·c2 (NO)·c(O2),故k =![]() ,
,
故答案为:增大;< ;活化能低,同条件下单位体积内活化分子数多,有效碰撞几率大,速率快;![]() ;
;
(3) 根据反应2NO(g)+O2 (g) =2NO2(g) △H1=-113kJ/mol 为放热反应,
则反应2NO2(g) ![]() 2NO(g)+O2(g)为吸热反应,从 b 点到 a 点降温平衡将向左移动。
2NO(g)+O2(g)为吸热反应,从 b 点到 a 点降温平衡将向左移动。
图中 a点对应温度下, NO2的起始压强为 160kPa, 设起始时NO2的物质的量为a,则
2NO2(g) ![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
起始(mol) a 0 0
转化(mol)0.6a 0.6a 0.3a
平衡(mol)0.4a 0.6a 0.3a
平衡时总物质的量为0.4a+0.6a+0.3a=1.3a,恒温恒容条件下,压强之比等于物质的量之比,平衡时总压强为160kPa![]() =208 kPa,
=208 kPa,
平衡时NO2、NO和O2的平衡分压分别为208 kPa×![]() =64 kPa、208 kPa×
=64 kPa、208 kPa×![]() =96 kPa、208 kPa×
=96 kPa、208 kPa×![]() =48kPa,
=48kPa,
Kp= ![]() =
=![]() =108kPa,
=108kPa,
故答案为:左 ;108kPa。


科目:高中化学 来源: 题型:
【题目】C,Si、B,N、Cl在工业生产中具有重要的应用,试回答下列问题:

(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠________结合在一起。
(2)现在新开发出一种具有和“龙芯”主要成分一样的六角形笼状结构单质Si12,它可能在未来的量子计算机中是一种理想的贮存信息的材料,根据图示推断这种六角形笼状结构:Si12是____晶体,它与单晶硅互称为________。
(3)SiC晶体结构与金刚石相似,碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。其中C原子的杂化方式为____________,微粒间存在的作用力是_____________,每个Si原子周围距离最近的C原子为______个,其键角为_________。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为____________________(用含A,b的式子表示)。
(4)氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BN。由于BN与CC属于等电子体物质,其结构和性质有很大的相似性。
①BN有两种晶体,对BN两种晶体的描述中不正确的是______ 。
A.其中一种晶体可用作耐磨材料
B.其中一种晶体可用作润滑材料
C.其中一种晶体键角为90°
D.其中一种晶体中存在六元环
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的作用力为________,层间作用力为__________。B原子和N原子的杂化类型分别是________、__________。
③六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为a cm,立方氮化硼晶胞中含有____个氮原子、_____个硼原子,晶胞顶点上的原子的配位数为______,立方氮化硼的密度是_________g·cm-3(阿伏加德罗常数为NA)。
④立方氮化硼比晶体硅具有更高硬度和耐热性的原因是_____________________________。
(5)已知氮化碳晶体是新发现的高硬度材料,且构成该晶体的微粒间只以单键结合。下列关于该晶体的说法错误的是____________。
A.氮化碳属于原子晶体,比金刚石中的硬度更大
B.该晶体中每个碳原子与4个氮原子相连,每个氮原子与3个碳原子相连,氮化碳的化学式为C3N4
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为______,基态Mn3+含有的未成对电子数是______。
(2) CH3COOH中碳原子的杂化形式为________。
(3) NO3-的空间构型是________,与NO3-互为等电子体的分子的化学式为__________(任写一种)。
(4) CH3COOH能与H2O以任意比互溶的原因是____________________。
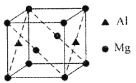
(5)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为_______,晶体中每个镁原子周围距离最近的铝原子数目为_______,该晶体的密度为______g/cm3(阿伏伽德罗常数的数值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴用作催化剂及制钴盐原料,陶瓷工业着色剂,电子、磁性材料的添加剂。利用以下装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成。

已知:碱式碳酸钴中钴为+2价,受热时可分解生成三种氧化物。请回答下列问题:
(1)选用以上装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成,其正确的连接顺序为a→b→____(按气流方向,用小写字母表示)。
(2)样品分解完,打开活塞K,缓缓通入氮气数分钟,通入氮气的目的是_______________。
(3)取碱式碳酸钴样品34.9 g,通过实验测得分解生成的水和二氧化碳的质量分别为3.6 g、8.8 g,则该碱式碳酸钴的化学式为______________________________。
(4)某兴趣小组以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种实验设计流程如下:

已知:25 ℃时,部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 1.9 | 7.0 | 7.6 | 3.4 |
完全沉淀(pH) | 3.2 | 9.0 | 9.2 | 4.7 |
①操作Ⅰ用到的玻璃仪器主要有___________、_____________、___________;
②加盐酸调整pH为2~3的目的为____________________________________________;
③操作Ⅱ的过程为_______________、_______________、____________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值, 下列叙述正确的是
A. 1mol H2O中含有的极性共价键数目为2NA
B. 16 g16O2和18O2混合物中含有的质子数目为8NA
C. Zn和浓硫酸反应得到22.4LSO2和 H2混合气体时, 转移的电子数为4NA
D. 标准状况下2 mol NO与1 mol O2充分反应后分子数共2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体表面的化学过程研究对于化学工业非常重要。在Fe催化剂、一定压强和温度下合成氨的反应机理如下图所示。下列说法不正确的是( )

A. N2和H2分子被吸附在铁表面发生反应
B. 吸附在铁表面的N2断裂了N≡N键
C. NH3分子中的N-H键不是同时形成
D. Fe催化剂可以有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e- =2CO32-+12H2O,7H2O+![]() O2+14e- =14OH-,有关此电池的推断正确的是
O2+14e- =14OH-,有关此电池的推断正确的是
A. 电解质溶液中电子向正极移动
B. 放电一段时间后,KOH的物质的量浓度不变
C. 通乙烷的电极为负极
D. 参加反应的O2和C2H6的物质的量之比为2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com