
 在全球一致倡导低碳经济的大背景下,对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
在全球一致倡导低碳经济的大背景下,对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.| c(CO)?c(O2) |
| c(CO2) |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| c(CO)?c(O2) |
| c(CO2) |
| c(CO)?c(O2) |
| c(CO2) |
 ;
; .
.


科目:高中化学 来源: 题型:
| A、2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| B、核磁共振仪、红外光谱仪、紫外光谱仪、质谱仪等都可用于有机化合物结构的分析 |
| C、石油裂解、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化 |
| D、维勒打破了无机物和有机物的界限,卢瑟福提出了带核的原子结构模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
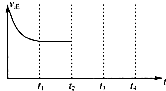 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因.| 催化剂 |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.| A-B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.1 mol碳酸钠晶体中含有CO32-的数目小于0.1 NA |
| B、36g CaO2中含有的离子数目为0.15 NA |
| C、100g 98%的浓硫酸中,氧原子总数为4NA |
| D、标准状况下,14.2g氯气与足量石灰乳充分反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS在水中的电离方程式为:NaHS═Na++HS-和HS-═H++S2- |
| B、同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3?H2O)>V(HCl) |
| C、Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D、同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com