
����Ŀ��NOx����ɴ�����Ⱦ����Ҫ���ʣ��û�ԭ������ת��Ϊ����Ⱦ�����ʣ���������������Ⱦ����Ҫ���塣
��1����֪��2C(s)+O2(g)![]() 2CO(g) ��H1= -221.0 kJ/mol
2CO(g) ��H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) ��H2= +180.5 kJ/mol
2NO (g) ��H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H3= -746.0 kJ/mol
2CO2(g)+N2(g) ��H3= -746.0 kJ/mol
�ش��������⣺
���ý�̿��ԭNO��������Ⱦ������Ȼ�ѧ����ʽΪ_______��
����һ���¶��£���ס��ҡ������������ܱ������м���һ������NO�������Ľ�̿����Ӧ�����в�ø�������c(NO)��mol/L����ʱ�䣨s���ı仯���±���
��֪�����������ķ�Ӧ�¶ȷֱ�ΪT��= 400�桢T��= 400�桢T��= a ��
ʱ�� | 0 s | 10 s | 20 s | 30 s | 40 s |
�� | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
�� | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
�� | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�������У��÷�Ӧ��ƽ�ⳣ��K=_______���������ķ�Ӧ�¶�a _______400�棨�������<����=������������_______��
��2����NH3����ԭNOx���������������Ⱦ��
��֪��8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ��H��0����ͬ�����£���2 L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ������з�Ӧ������N2������ʱ��仯��ͼ��ʾ��
7N2(g) +12H2O(l) ��H��0����ͬ�����£���2 L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ������з�Ӧ������N2������ʱ��仯��ͼ��ʾ��

���ڴ���A�������£�0��4 min��v(NH3) = _______��
�ڸ÷�Ӧ���Ea(A)��Ea(B)��Ea(C)�ɴ�С��˳����_______��������_______��
������˵����ȷ����_______�����ţ���
a��ʹ�ô���A��ƽ��ʱ����Hֵ����
b�������¶ȿ�ʹ������������ɫ����
c����λʱ�����γ�N-H����O-H������Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��
d�����ں��ݾ��ȵ��ܱ������з�Ӧ����ƽ�ⳣ������ʱ��˵����Ӧ�Ѿ��ﵽƽ��
���𰸡� 2NO(g)+ C (s)![]() CO2(g)+ N2(g) ��H=-573.75kJ/mol
CO2(g)+ N2(g) ��H=-573.75kJ/mol ![]() �ס��������з�Ӧ����ʼ����ͬ����������ƽ���ʱ��ȼ�������ƽ���ʱ��� 0.5mol/��L
�ס��������з�Ӧ����ʼ����ͬ����������ƽ���ʱ��ȼ�������ƽ���ʱ��� 0.5mol/��L![]() min�� Ea(C) Ea(B) Ea(A) ��ͬʱ�������ɵ�N2Խ�࣬��Ӧ����Խ�죬���Խ�� b c d
min�� Ea(C) Ea(B) Ea(A) ��ͬʱ�������ɵ�N2Խ�࣬��Ӧ����Խ�죬���Խ�� b c d
����������1����2C(s)+O2(g) ![]() 2CO(g) ��H1= -221.0 kJ/mol
2CO(g) ��H1= -221.0 kJ/mol
��N2(g)+O2(g)![]() 2NO (g) ��H2= +180.5 kJ/mol
2NO (g) ��H2= +180.5 kJ/mol
��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H3= -746.0 kJ/mol
2CO2(g)+N2(g) ��H3= -746.0 kJ/mol
���ý�̿��ԭNO��������Ⱦ����Ļ�ѧ����ʽΪ��2NO(g)+ C (s)![]() CO2(g)+ N2(g)���÷���ʽ������+��-�ڣ�/2�������ʸ÷�Ӧ�ġ�H=����H3+��H1- ��H2��/2=-573.75kJ/mol���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ��2NO(g)+ C (s)
CO2(g)+ N2(g)���÷���ʽ������+��-�ڣ�/2�������ʸ÷�Ӧ�ġ�H=����H3+��H1- ��H2��/2=-573.75kJ/mol���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ��2NO(g)+ C (s)![]() CO2(g)+ N2(g) ��H=-573.75kJ/mol��
CO2(g)+ N2(g) ��H=-573.75kJ/mol��
�ڼ������У�������Ӧ2NO(g)+ C (s)![]() CO2(g)+ N2(g)����������c(NO)��mol/L����ʱ�䣨s���ı仯��
CO2(g)+ N2(g)����������c(NO)��mol/L����ʱ�䣨s���ı仯��
2NO(g)+ C (s)![]() CO2(g)+ N2(g)
CO2(g)+ N2(g)
��ʼŨ�� 2 0 0
ת��Ũ�� 1.2 0.6 0.6
ƽ��Ũ�� 0.8 0.6 0.6
�ʸ÷�Ӧ��ƽ�ⳣ��K= ![]() =
= ![]() ���ס��������з�Ӧ����ʼ����ͬ����������ƽ���ʱ��ȼ�������ƽ���ʱ��̣��ʱ������ķ�Ӧ�¶�a 400�棻
���ס��������з�Ӧ����ʼ����ͬ����������ƽ���ʱ��ȼ�������ƽ���ʱ��̣��ʱ������ķ�Ӧ�¶�a 400�棻
��2����NH3����ԭNOx���������������Ⱦ��
���ڴ���A�������£�0��4 min��v(NH3) =![]() =0.5mol/��L
=0.5mol/��L![]() min����
min����
�ڸ���ͼ��ABC������Ч��A>B>C����ͬʱ�������ɵ�N2Խ�࣬��Ӧ����Խ�죬���Խ�ͣ��ʸ÷�Ӧ���Ea(A)��Ea(B)��Ea(C)�ɴ�С��˳����Ea(C) Ea(B) Ea(A)��
��a����������Ӱ���Hֵ����a����b�������¶ȿ�ʹƽ�����ƣ�ʹ�ö�������Ũ������������������ɫ�����b��ȷ��c�����ݷ�Ӧ��8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l)����λʱ��������8��NH3��ͬʱ����12��H2Oʱ��˵����Ӧ�Ѿ��ﵽƽ�⣬���γ�N-H����O-H������Ŀ���ʱ����c��ȷ��d�����ں��ݾ��ȵ��ܱ������з�Ӧ����ƽ�ⳣ������ʱ��˵���¶��Ѿ����䣬˵����Ӧ���������仯��˵����Ӧ�Ѿ��ﵽƽ�⣬��d��ȷ����ѡb c d��
7N2(g) +12H2O(l)����λʱ��������8��NH3��ͬʱ����12��H2Oʱ��˵����Ӧ�Ѿ��ﵽƽ�⣬���γ�N-H����O-H������Ŀ���ʱ����c��ȷ��d�����ں��ݾ��ȵ��ܱ������з�Ӧ����ƽ�ⳣ������ʱ��˵���¶��Ѿ����䣬˵����Ӧ���������仯��˵����Ӧ�Ѿ��ﵽƽ�⣬��d��ȷ����ѡb c d��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���ͬ��������������������ʵ����������ǣ� ��
A.Cl2B.O2C.N2D.CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɢϵ�ı����� �� ��
A.����ķ�ɢ������ֱ����1 nm��100nm֮��
B.�������Ӵ���ɲ�����һ�����������ȶ�����
C.����������ͨ����ֽ��϶
D.���������ܹ����������˶������ܲ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ��߾���I��J���������������й㷺Ӧ�ã���ϳ�·����ͼ:

������R�ķ���ʽΪC9H10���䱽����ֻ��һ��ȡ������R��H21:1�ӳɺ����ĺ˴Ź�����������5��壬�����֮��Ϊ1:2:2:1:6��
��֪:R'CH=CH2![]() R'CH2CH2Br
R'CH2CH2Br
�ش���������:
(1)������R���ӵĹ�������_________(������ŷ���)��R�����ͬϵ����_____(�ѧ����)��
(2)��Ӧ���Ļ�ѧ����ʽΪ__________________��
(3)�������ķ�Ӧ���ͷֱ�����____________��______________________��
(4)�߾���J�Ľṹ��ʽΪ________________________��
(5)��Ӧ���ķ�Ӧ������______________________��
(6)H��T��Ϊͬ���칹�壬������������������H���ӹ���________�֡�
���ܷ���������Ӧ�����Ȼ�����Һ��Ӧ����ɫ����ʹ���������̼��Һ��ɫ
(7)���������ϳ�·�ߣ����һ����RΪ��Ҫԭ���Ʊ� �ĺϳ�·��(���Լ���ѡ):____________________________________________________��
�ĺϳ�·��(���Լ���ѡ):____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ܽ�Fe2��ת��ΪFe3������
��������ˮ����п����ϡ���ᡡ��ͭ ����
A. �٢ڢ� B. �ڢܢ� C. �٢� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������˵����ȷ����
A.2.4g����þ����������ĿΪ0.2NAB.16g CH4����ԭ����ĿΪNA
C.17gNH3����������ĿΪ10 NAD.20g��ˮ��D2O������������ĿΪ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȼ�ϵ�ص���±ˮ����±ˮ��Cl-��Br-��Na+��Mg2+����װ����ͼ��ʾ��a��b��Ϊʯī�缫���������й�˵����ȷ����
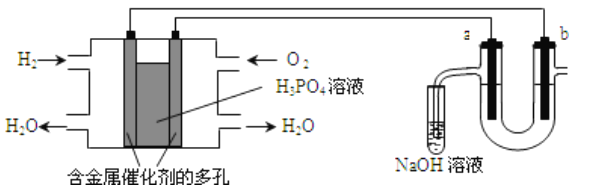
A. ȼ�ϵ�ع���ʱ��������ӦΪ��O2+4H++2e-===2H2O
B. ���ʱ������������·���ǣ����������·����������Һ������������
C. ����������ģ������������1.12LO2����״����ʱ��b����Χ�����0.1gH2
D. ���ʱ��a�缫��Χ���ȷŵ����Br-������Cl-��˵��������������ͬʱǰ�ߵĻ�ԭ��ǿ�ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ù�������������ȡ��������(Fe2O3)��Ӧԭ���ǣ�2FeSO4![]() Fe2O3��SO2����SO3����ijѧ��������÷�Ӧ����������̬���ʣ����ν�����ͨ��ʢ��A��B��C����װ�á�
Fe2O3��SO2����SO3����ijѧ��������÷�Ӧ����������̬���ʣ����ν�����ͨ��ʢ��A��B��C����װ�á�

��1��B��ʢ�ŵ���Һ������_________________��
��2��A�зű���������_______________________��
��3�����һ����ʵ�鷽��̽��A�еõ��ij����ijɷ֡�___________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com