
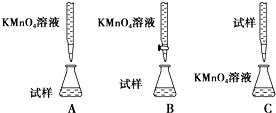
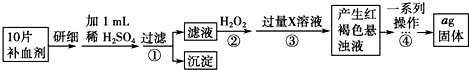
分析 (1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
(2)酸性溶液或强氧化性溶液应用酸式滴定管;
(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀为氢氧化亚铁,空气中氢氧化亚铁被氧化生成氢氧化铁;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
Ⅱ.(1)趁热过滤的目的和理由减少硫酸亚铁损失,过滤掉不溶性杂质;
(2)①向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作蒸发浓缩、冷却结晶、过滤洗涤后得到六水合硫酸亚铁铵晶体;
②六水合硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]为浅绿色晶体,易溶于水,不溶于酒精.
解答 解:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(2)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀为氢氧化亚铁,空气中氢氧化亚铁被氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)步骤④中一系列操作依次是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;洗涤;灼烧;冷却;
II:(1)趁热过滤的目的和理由是过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失,
故答案为:过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失;
(2)①向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作蒸发浓缩、冷却结晶、过滤洗涤后得到六水合硫酸亚铁铵晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
②硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水,
故答案为:乙醇.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l)△H1 2H2(g)+O2(g)=2H2O(g)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+O2(g)=CO(g)△H1 C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁的化学式:FeO | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | |
| D. | 质子数为53,中子数为78的碘原子表示为:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ④⑥ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
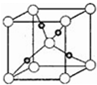 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

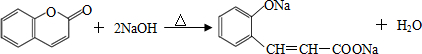 .
. 、
、 、
、 (其中三种).
(其中三种). 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
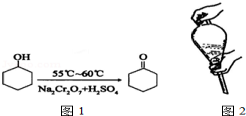 环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环乙醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com