
【题目】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:
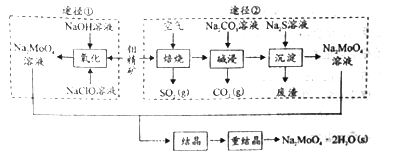
回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是____________。

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有__________________。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是________________________。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______%。(保留三位有效数字)。
Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________(保留三位有效数字)。[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入 Ba(OH)2固体引起溶液体积变化可忽略]。

【答案】 B 充分粉碎矿石 MOS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O 母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度 97.3% Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得碳钢在盐酸中的腐蚀速率明显快 7.28×10-4 mol·L-1
【解析】Ⅰ.(1)NaClO是强氧化剂,应在保存NaClO容器上贴上的标志是氧化剂,答案选B;(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎矿石或逆流焙烧;(3)途径①制备钼酸钠溶液,用NaClO在碱性条件下氧化MoO3,同时有SO42-生成,反应的离子方程式为MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;(4)母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度,故重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理;(5)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=![]() =1×10-7mol/L,溶液中硫酸根离子的浓度为:c(SO42-)=
=1×10-7mol/L,溶液中硫酸根离子的浓度为:c(SO42-)=![]() mol/L=1.1×10-3mol/L,硫酸根离子的去除率为:1-
mol/L=1.1×10-3mol/L,硫酸根离子的去除率为:1-![]() ×100%=1-2.75%≈97.3%;
×100%=1-2.75%≈97.3%;
Ⅱ.(1)由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,即答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;(2)根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,所以钼酸钠的浓度为:150mgL-1,1L溶液中含有的钼酸钠物质的量为:![]() ≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1。
≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1。


科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
Cu、Ni、V为制造合金及合成催化剂的重要元素。
请回答:
(1)Cu元素位于元素周期表的_________区,其基态原子有_________种能量不同的电子。
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种);NH3分子的VSEPR模型为_______________。
(3)Ni(CO)4的熔点为-25℃,沸点为43℃。其晶体类型为___________。晶体中σ键和π键的数目之比为_________。
(4)Ni可作为 或
或![]() 与H2加成的催化剂。在相同压强下,
与H2加成的催化剂。在相同压强下, 的沸点比
的沸点比![]() 低,原因为_________________。
低,原因为_________________。
(5)  有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
(6)已知:钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分別为a nm、bnm,阿伏加德罗常数的值为NA。则该晶体的密度为________g /cm3(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的O2和O3,分子数之比为______;O原子数之比为_____;同温同压下密度比为_____。
(2)标准状况下;1.806×l023个CO2分子的体积为____L,与_____g H2O含有O 原子数目相同,此CO2气体与足量的Na2O2固体完全反应后,固体的质量增加______g。
(3)将4g NaOH固体溶于水配成500mL 溶液,所得溶液的物质的量浓度为___mol/L。
① 若从中取出10mL,加水稀释到50mL,则稀释后NaOH 溶液的物质的量浓度为___mol/L。
② 若从中取出10mL,需要加入0.5mol/L盐酸_______mL 才能恰好反应。
(4)标准状况下,将VL某气体(相对分子质最为M)溶解在aL水中(水的密度近似为1g/mL) , 所得溶液的密度为ρg/mL,则溶质的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 醋酸的电离程度增大,溶液中导电粒子的数目减少
C. 若稀释到pH=4,所需水的体积等于90mL
D. 再加入10mLpH=11的NaOH溶液,混合后溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关100mL 0.1mol/L K2SO4溶液的叙述正确的是
A. 含有0.1molK2SO4 B. 水的体积为0.1L
C. c(K+)=0.2 mol/L D. 取出10mL溶液,c(K2SO4)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑化剂是一种对人体有害的物质。增塑剂DCHP可由邻苯二甲酸酐与环已醇反应制得。下列说法不正确的是

A. DCHP的分子式为C20H26O4
B. 该反应属于取代反应
C. DCHP的一氯取代产物有6种
D. 与环已醇分子式相同,且具有醛基(-CHO)的结构共有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某实验室需要配制480 mL 0.10 mol/L Na2CO3溶液。

①所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、______________________。
②实验时图中所示操作的先后顺序为________________(填编号)
(2)现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制500mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
①上述仪器中,在配制稀硫酸时不需要用到的是_______________________(填序号)
②经过计算,需要量取浓硫酸的体积为_______。今有①10mL ②50mL ③100mL 三种规格的量,你选用的规格是_________(填序号)
③配制操作可分解成如下几步,以下正确的操作顺序是____________________________
A、 向容量瓶中注入少量蒸馏水,检查是否漏水
B、 用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C、 用已冷却的稀硫酸注入已检查不漏水的100mL容量瓶中
D、 根据计算,用量筒量取一定体积的浓硫酸
E、 将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F、 盖上容量瓶塞子,振荡,摇匀
G、 用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H、 继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1-2 cm处
④在配制过程中,下列操作错误的是______,能使所配溶液浓度偏高的是______(填序号)
a.洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
b.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
c.定容时,俯视刻度线
d.将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
e.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
f.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑤向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面将导致所配溶液浓度__________(填“偏高”、“偏低”或“无影响”),针对这种情况,你将如何处理_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A.5 min时该反应的K值一定小于12 min时的K值
B.0~5 min内,v(H2)=0.05 mol/(L·min)
C.10 min时,改变的外界条件可能是减小压强
D.该反应混合气体的平均相对分子质量:5 min时小于12 min 时的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com