氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.
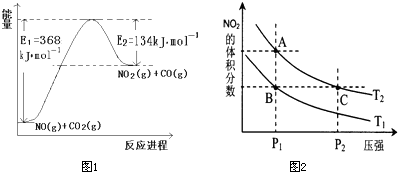
(1)图是1mol NO
2和1mol CO反应生成CO
2和NO过程中能量变化示意图1,请写出NO
2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
;
又知:N
2 (g)+O
2 (g)=2NO(g)△H=+180kJ?mol
-1;2NO(g)+O
2(g)=2NO
2(g)△H=-112.3kJ?mol
-1;则反应:2NO(g)+2CO
2(g)?N
2(g)+2CO
2(g)的△H=
-760.3kJ?mol-1
-760.3kJ?mol-1
;
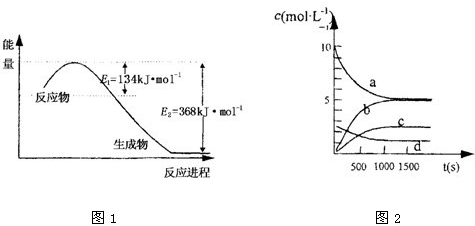
(2)一定温度下,在2L密闭容器中NO
2和O
2可发生下列反应:4NO
2(g)+O
2 (g)?2N
2O
5(g);已知体系中n(NO
2)随时间变化如下表:
| t(s) |
0 |
500 |
1000 |
1500 |
| n(NO2)(mol) |
20 |
13.96 |
10.08 |
10.08 |
①写出该反应的平衡常数表达式:K=
,已知:K
300℃>K
350℃,则该反应是
放
放
热反应
②反应达到平衡后,NO
2的转化率为
49.6%
49.6%
,此时若再通入一定量氮气,则NO
2的转化率将
不变
不变
(填“增大”、“减小”、“不变”);
③如图2中表示N
2O
5 的浓度的变化曲线是
c
c
,用O
2表示从0~500s内该反应的平均速率v=
1.51×10-3mol/(L?s)
1.51×10-3mol/(L?s)
.




 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.