
����Ŀ������A��B��������Ԫ�أ�������Ԫ��������ͬ��A�ڼ��������·������±仯����֪������D��ʹ�����ǵ�ľ����ȼ������ɫ�ܲ�����A��B��C����ɫ��Ӧ��Ϊ��ɫ����C����Һ�м���AgNO3��Һ�����ְ�ɫ�������ټ���ϡ���ᣬ�������ܽ⣬�ҳ�������Ϊ14.35 �ˡ���ش�
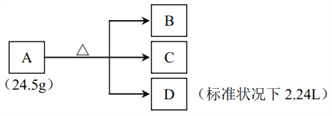
��1��C �Ļ�ѧʽΪ___________��
��2��д�� A �ֽ�Ļ�ѧ����ʽ___________��
��3����A��C��ϣ��ټ���ϡ���ᣬ����������������ӷ���ʽ��ʾ�����ķ�Ӧ___________��
���𰸡� KCl 2KClO3 = KClO4+KCl+O2�� ClO3-+5Cl-+6H��=3Cl2 +3H2O
�����������������֪DΪ����Ϊ0.1mol��C����Һ�м���AgNO3��Һ�����ְ�ɫ�����Ȼ���14.35 �ˣ���0.1mol��˵��C�к�1�������ӣ�C��ΪKCl��AΪKClO3�����ݵ��ӵ�ʧ�غ㣬KClO3����Ԫ����+5���͵�-1�ۣ��õ���������Ϊ0.6 mol����Ԫ��ʧ���ӵ���Ϊ0.1��4=0.4 mol<0.6����Ϊ����A��B��������Ԫ�أ�������Ԫ��������ͬ������B����Ԫ�ػ��ϼ۱������ߣ�������������غ㣬����BΪKClO4��
��1��ͨ�����Ϸ�����֪C �Ļ�ѧʽΪKCl����ȷ�𰸣�KCl��
��2���������Ϸ�����֪������ؼ��ȷֽ�Ϊ������ء��Ȼ��غ���������ѧ����ʽΪ��2KClO3 = KClO4+KCl+O2������ȷ�𰸣�2KClO3 = KClO4+KCl+O2����
��3��KClO3��KCl��ϣ��ټ���ϡ���ᣬ��Ԫ�ط���������ԭ��Ӧ�������������ӷ���ʽΪ��ClO3-+5Cl-+6H��=3Cl2 +3H2O����ȷ�𰸣�ClO3-+5Cl-+6H��=3Cl2 +3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥCO2�л��е�����SO2���壬���ѡ�õ��Լ��ǣ� ��
A.����ʯ��ˮ
B.Ʒ����Һ
C.NaOH��Һ
D.����NaHCO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�·����ϳɷ֣���72%��������ά28%������˵����ȷ����
A. ������Ҫ�ɷ�Ϊ��ά��
B. ������ά������Ȼ��ά
C. ϴ�Ӹ��·����ʺ��ü�øϴ�Ӽ�
D. ���·������ֳɷ־����ںϳɲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ�BaCl2�ۻ����ڸɱ���������������ȼ���ܵ������ĸ������У�����Ҫ�ƻ���ѧ������ �� ��Ҫ�ƻ����ۼ����� �� ��Ҫ�ƻ����Ӽ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�� H3A ˮ��Һ(һ������Һ)�к� A �ĸ������ӵķֲ�������ƽ��ʱij�����ӵ�Ũ��ռ��������Ũ��֮�͵ķ����������� pH �Ĺ�ϵ��ͼ��ʾ������������ȷ����( )
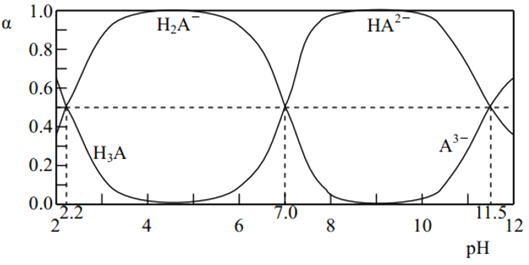
A. ����ͼ���ɵ� Ka1(H3A )��10��7
B. �������ʵ����� NaH2A �� Na2HA ���������ˮ�����õ���Һ�� ��(H2A��)����(HA2-)
C. �Է�̪Ϊָʾ������ɫ��Χ pH 8.2��10.0������ NaOH ��Һ��μ��뵽 H3A ��Һ�У�����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӣ������� NaH2A
D. �������� A �ĸ������ӵ���ϵ�У��� c(H2A��)��5c(A3��)��c(OH��)��c(H+)������ҺpHΪ11.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ��ϩ�ķ�Ӧԭ��Ϊ��CH3CH2OH![]() CH2��CH2��+H2O��ѡ����ͼA���з�Ӧ���������¶ȹ��߶�ʹ�Ҵ���Ũ�������������Ķ������������������ʵ����ȷ��������������д�����ϩ�Ͷ��������Իش��������⡣
CH2��CH2��+H2O��ѡ����ͼA���з�Ӧ���������¶ȹ��߶�ʹ�Ҵ���Ũ�������������Ķ������������������ʵ����ȷ��������������д�����ϩ�Ͷ��������Իش��������⡣
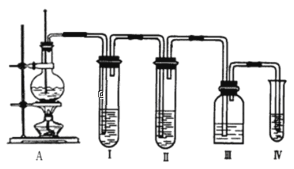
��1���������������Լ���ѡ����������Լ�����������������������ǣ�______�����ظ�������ĸ����
A.Ʒ����Һ B.NaOH��Һ C.ŨH2SO4 D.��ˮ
��2����˵����������������ڵ�������______��
��3��ʹ��װ�â��Ŀ����______��
��4��ȷ��������ϩ��������______��
��5��д��IV�з����Ļ�ѧ��Ӧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������ʱ仯�ıȽϣ�����ȷ���ǣ� ��
A.��ԭ��ǿ����F����Cl����I��
B.ԭ�Ӱ뾶��С��Na��S��O
C.����ǿ����KOH��NaOH��LiOH
D.�ȶ���ǿ����HF��HCl��HBr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T1��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������A�����B���壬�������·�Ӧ��A(g) +2B(g)![]() C(p)����Ӧ�����вⶨ�IJ������ݼ��±���
C(p)����Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(A)/mol | n(B)/ mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
����˵���������
A. ǰ10min�ڷ�Ӧ��ƽ������Ϊv(C)=0.0250 mnol��L-1��min-1
B. ���������������䣬��ʼʱ�������г���0.50molA�����0.60mo1B���壬����ƽ��ʱ��n(C)<0.25mo1
C. ������������ʱ����ƽ����ϵ���ٳ���0.50molA����ԭƽ����ȣ���ƽ��ʱB��ת��������A�������������
D. �¶�ΪT2��ʱ(T1>T2)��������Ӧƽ�ⳣ��Ϊ20��������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���NO��NO2��������ȷ���ǣ�������
A.NO��һ�ֺ���ɫ����
B.���³�ѹ�£�NO����������е�����ֱ�ӻ���
C.������������Ԫ�ص�NO��CO�����ʵ������
D.NO2������ˮ���ռ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com