
A、MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl
| ||||
| B、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | ||||
| C、氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | ||||
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、若金属没有剩余,反应中转移的电子数目为2y NA | ||
| B、若金属全部溶解,则溶液中一定含有Fe3+ | ||
C、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-
| ||
| D、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅①④ | B、仅①②④ |
| C、除⑤外 | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量就是物质的数量 |
| B、1mol任何物质都含有6.02×1023个原子 |
| C、1mol水中含有1mol氢分子和1mol氧原子 |
| D、1mol H2分子中含有2mol H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有不同种元素的纯净物叫做化合物 |
| B、水溶液中能电离出H+的化合物一定是酸 |
| C、盐中一定含有金属元素 |
| D、含有氧元素的化合物一定是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁和铝与同浓度的盐酸反应铝没镁反应剧烈,所以铝比镁的金属性强 |
| B、Mg(OH)2溶液的碱性比NaOH溶液的碱性弱,所以镁比钠的金属性强 |
| C、铁能从CuSO4溶液中置换出铜,所以铁比铜的金属性强 |
| D、电解含Ag+和Cu2+的溶液时,Ag+优先放电,所以银比铜的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
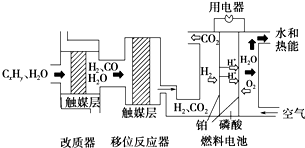 磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )| A、该系统中只存在化学能和电能的相互转化 | ||
B、在移位反应器中,反应CO(g)+H2O(g)
| ||
| C、改质器和移位反应器的作用是将CxHy转化为H2和CO2 | ||
| D、该电池正极的电极反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示:
X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示:| 元素 | 相关信息 |
| X | X原子的价电子构型为nsn |
| Y | Y与R位于同主族 |
| Z | Z是除稀有气体外第一电离能最大的元素 |
| W | W的单质是人们将太阳能转换为电能的常用材料 |
| M | M是人们生活中最常用的金属 |
| I1 | I2 | I3 | I4 | I5 | |
| R的电离能/kJ?mol-1 | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com