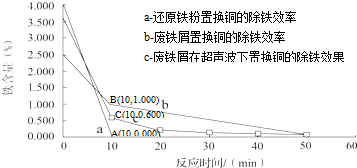
考点:晶胞的计算,原子核外电子排布,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,
Z是除稀有气体外第一电离能最大的元素,则Z是F元素;
W的单质是人们将太阳能转换为电能的常用材料,则W为Si元素;
M是人们生活中最常用的金属且原子序数大于W,所以M是Fe元素;
根据R电离能大小知,R元素位于第IIIA族,且R原子序数大于F而小于Si,所以R是Al元素;
Y和R位于同一主族,且原子序数小于Al,所以Y为B元素;
X原子的价电子构型为ns
n,且这几种元素位于相邻的前四个周期,所以X位于第一周期,为H元素;
(1)X
为H元素,其原子核外有1个电子,据此书写H原子电子排布图;
(2)根据价层电子对互斥理论确定中心原子杂化方式及分子空间构型;
(3)分子晶体熔点较低;
(4)一个Si原子连接4个Si原子,所以每个硅原子占有2个Si-Si键,据此计算1molSi中Si-Si键数目;
原子晶体熔沸点与其键长成反比,与键能成正比;
(5)M为Fe元素,Fe原子3d、4s能级上电子为其价电子,根据构造原理书写M原子的价电子排布式;
该晶胞中最近的两个M原子之间的距离为中心原子和顶点原子距离,其中心原子到顶点距离为晶胞边长的
.
解答:
解:X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,
Z是除稀有气体外第一电离能最大的元素,则Z是F元素;
W的单质是人们将太阳能转换为电能的常用材料,则W为Si元素;
M是人们生活中最常用的金属且原子序数大于W,所以M是Fe元素;
根据R电离能大小知,R元素位于第IIIA族,且R原子序数大于F而小于Si,所以R是Al元素;
Y和R位于同一主族,且原子序数小于Al,所以Y为B元素;
X原子的价电子构型为ns
n,且这几种元素位于相邻的前四个周期,所以X位于第一周期,为H元素;
(1)X
为H元素,其原子核外有1个电子,其电子排布图为
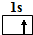
,故答案为:
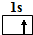
;
(2)化合物BF
3的中心原子B的价层电子对个数=3且不含孤电子对,所以B原子的杂化类型为sp
2杂化,则BF
3的空间结构为平面三角形,故答案为:sp
2;平面三角形;
(3)Z为F元素,D与Z同主族且相邻,则D为Cl元素,D和R形成的化合物的化学式(或分子式)为Al
2Cl
6,熔点:190℃,所以晶体Al
2Cl
6为分子晶体,故答案为:分子;
(4)一个Si原子连接4个Si原子,所以每个硅原子占有2个Si-Si键,则1molSi中Si-Si键数目为2N
A;
C的原子半径小于Si,吸引电子能力大于Si,Si和C生成SiC,C-Si键键长小于Si-Si键,键能C-Si键大于Si-Si,所以SiC的熔点高于晶体硅,
故答案为:2N
A;>;C的原子半径小于Si,吸引电子能力大于Si,因而键长C-Si键小于Si-Si键,而键能C-Si键大于Si-Si,所以SiC的熔点高于晶体硅;
(5)M为Fe元素,Fe原子3d、4s能级上电子为其价电子,根据构造原理知M原子的价电子排布式为3d
64s
2;
该晶胞中最近的两个M原子之间的距离为中心原子和顶点原子距离,其中心原子到顶点距离为晶胞边长的
,该晶胞中原子个数=1+8×
=2,设晶胞的边长为x,则晶胞体积为x
3,其密度ρ=
,所以V=
cm
3=
cm
3,则中心原子到顶点距离=
×cm,故答案为:3d
64s
2;
×.
点评:本题涉及晶体类型判断、晶胞计算、原子杂化方式判断、分子空间构型判断等知识点,根据价层电子对互斥理论、晶胞计算公式等知识点分析解答即可,同时考查学生空间想象能力、数学运算能力等,题目难度中等.

 X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示:
X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示: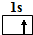 ,故答案为:
,故答案为: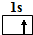 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案