
| 5 |
| n |
| 2 |
| 10×0.02mol?L-1×0.02L |
| 0.01mol×87g/mol |
| 1.2g |


科目:高中化学 来源: 题型:
| A、仅①④ | B、仅①②④ |
| C、除⑤外 | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
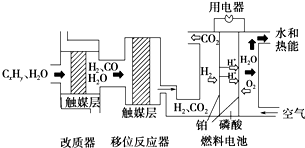 磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )| A、该系统中只存在化学能和电能的相互转化 | ||
B、在移位反应器中,反应CO(g)+H2O(g)
| ||
| C、改质器和移位反应器的作用是将CxHy转化为H2和CO2 | ||
| D、该电池正极的电极反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示:
X、Y、Z、R、W、M五种元素分别位于周期表中四个紧邻的周期,原子序数依次增大,其它相关信息如下列两表所示:| 元素 | 相关信息 |
| X | X原子的价电子构型为nsn |
| Y | Y与R位于同主族 |
| Z | Z是除稀有气体外第一电离能最大的元素 |
| W | W的单质是人们将太阳能转换为电能的常用材料 |
| M | M是人们生活中最常用的金属 |
| I1 | I2 | I3 | I4 | I5 | |
| R的电离能/kJ?mol-1 | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com